Resumen
Objetivo: Evaluar y comparar los efectos de la inhibición de la aromatasa a corto plazo en el metabolismo de la glucosa, perfil lipídico, y niveles de adipocitos en hombres jóvenes y ancianos.
Diseño y métodos: Diez ancianos y nueve jóvenes sanos fueron asignados al azar para recibir letrozol 2,5 mg diarios o placebo durante 28 días en un diseño cruzado.

Resultados: Tanto en los hombres jóvenes como en los ancianos, el tratamiento activo aumentó significativamente la testosterona sérica (+128 y +99%, respectivamente) y disminuyó los niveles de estradiol (–41 y --62%, respectivamente). Los niveles de glucosa e insulina en ayunas disminuyeron en los hombres jóvenes después de la intervención activa (–7 y --37%, respectivamente) en comparación con el placebo. Los niveles de leptina cayeron notablemente en ambos grupos de edad (–24 y --25%, respectivamente), mientras que los niveles de adiponectina no se vieron afectados por la intervención. El perfil lipídico fue ligeramente afectado en ambos grupos, con el aumento de los niveles de lipoproteínas-colesterol de baja densidad (LDL aka “colesterol malo”) (+14%) en el grupo de edad más joven y niveles 10% más bajos de APOA1 en los ancianos.
Una disminución en los niveles de IGF1 (-15%) fue observada en el grupo de edad más joven al recibir letrozol 2,5 mg diarios.
No se observaron cambios en el peso o el índice de masa corporal en jóvenes o ancianos.
Conclusiones: La inhibición de la aromatasa a corto plazo parece afectar al metabolismo de la glucosa en los hombres jóvenes, y el metabolismo de los lípidos, incluyendo la secreción de leptina, en hombres jóvenes y ancianos. Además, el corto período de exposición sugiere que estos cambios podrían estar mediados por los efectos directos de los esteroides sexuales en lugar de por los cambios en la composición corporales.
Introducción
Recientemente se ha propuesto la administración de inhibidores de la aromatasa a los hombres como una posible opción terapéutica en los hombres de edad avanzada con bajos niveles de testosterona (T) sérica (1), y en el hipogonadismo masculino relacionado con la obesidad (2, 3).
Sin embargo, sigue habiendo dudas sobre la eficacia y la seguridad a largo plazo de estos compuestos (4), y actualmente se sabe poco sobre los efectos a corto plazo de la inhibición de la aromatasa en el metabolismo de la glucosa y los lípidos.
A partir de los datos epidemiológicos, sabemos que la disminución de los niveles de testosterona en los hombres, relacionada con el envejecimiento, suele estar asociada con un aumento de la grasa (abdominal), la pérdida de masa muscular y ósea, una menor tolerancia a la glucosa, niveles elevados de lípidos y una mayor prevalencia de la aterosclerosis (5). Dado que todas estas características son similares a las observadas en los pacientes con deficiencia de andrógenos (5), se ha formulado la hipótesis de que la disminución de los niveles de testosterona contribuye al menos a algunos aspectos de este perfil metabólico perjudicial. Una hipótesis que explica este ciclo progresivo de enfermedad hipogonada-obesidad-metabólica es que el aumento de la actividad de la aromatasa causado por el aumento de la acumulación de tejido adiposo conduce a la depresión de la producción de testosterona, lo que aumenta aún más la deposición de grasa abdominal (6).
Desde este punto de vista, la administración de inhibidores de la aromatasa a hombres con hipogonadismo hipogonadotrópico (relacionado con la obesidad) puede ofrecer una opción terapéutica alternativa para restablecer el equilibrio alterado entre los niveles de esteroides sexuales. Hemos informado anteriormente de que la administración oral durante 28 días de un inhibidor de la aromatasa aumentó notablemente los niveles séricos de LH y T, al tiempo que redujo los niveles de estradiol (E2), tanto en los hombres jóvenes como en los de edad avanzada (7). En estos dos grupos de edad, ahora examinamos y comparamos los efectos de la inhibición de la aromatasa a corto plazo en su perfil metabólico midiendo los niveles séricos de insulina en ayunas, glucosa, lípidos, leptina, factor de crecimiento similar a la insulina 1 (IGF1) y adiponectina. La justificación era que los cambios observados después de un tratamiento a corto plazo tienen más probabilidades de reflejar los efectos directos de los cambios hormonales inducidos por la inhibición de la aromatasa, mientras que los cambios en el perfil metabólico después de un tratamiento a más largo plazo tienen más probabilidades de reflejar, al menos en una parte sustancial, los efectos indirectos resultantes de los cambios en la composición corporal.
Temas y métodos
Sujetos de estudio
Los detalles de la selección y aleatorización de los sujetos se han descrito anteriormente (7). En resumen, reclutamos 10 hombres jóvenes sanos (20-33 años, edad media 25.9 -+4.6 años) y 10 ancianos sanos (68-81 años, edad media 76.1 -+ 5 años) que dieron su consentimiento informado por escrito para participar en este estudio, aprobado por el Consejo de Revisión Ética del Hospital Universitario de Gante. Los sujetos debían tener una historia médica normal, un examen físico y medidas bioquímicas de la función hematológica, hepática, renal, gonadal y metabólica en la evaluación. Se consideraron como criterios de exclusión el tabaquismo, el abuso excesivo de alcohol o de sustancias y los trastornos activos. Uno de los participantes del grupo de edad más joven tenía diabetes mellitus de tipo 1 y por esta razón fue excluido del presente análisis.
Diseño del estudio
El diseño del estudio fue una intervención cruzada aleatoria, doble ciego y controlada por placebo (7). Los pacientes fueron examinados por primera vez 2 semanas antes del comienzo de la intervención. El placebo o el letrozol (2,5 mg diarios, Femara; Novartis AG, Stein, Suiza) tomado por vía oral al despertar, se administró en orden aleatorio cada día durante un período de 28 días, separado por un período de descanso sin tratamiento de 14 días. En ambos grupos de edad, el mismo número de sujetos (nZ5) comenzó con el inhibidor de la aromatasa. El cumplimiento se evaluó mediante el recuento de píldoras. Se obtuvo una muestra de sangre venosa después de un ayuno nocturno y 10 minutos de reposo en cama entre las 0800 y las 1000 hrs. Debido a un prominente efecto de remanencia de la administración de letrozol en el día 43, se excluyeron del análisis estadístico los datos de la fase con el placebo de los participantes que utilizaron el placebo en la segunda fase del estudio.
Ensayos hormonales y bioquímicos
El suero se almacenó en el -80 Celsius hasta su análisis; todas las muestras del mismo sujeto se analizaron en una sola prueba. Las concentraciones de triglicéridos en ayunas, fracciones de colesterol, glucosa y suero de insulina se determinaron utilizando ensayos de laboratorio estándar (inmunoensayo modular, Roche Diagnostics). Los coeficientes de variación (CV) intra e interensayo para todos los parámetros fueron inferiores al 6 y al 3% respectivamente. Las concentraciones plasmáticas de apolipoproteínas A1 (APOA1) y B (APOB) se determinaron mediante nefelometría (Siemens Healthcare Diagnostics Inc., Deerfield, IL, EE.UU.). Se utilizaron inmunoensayos comerciales para determinar la E2 sérica (Incstar, Stillwater, MN, EE.UU.; protocolo adaptado con el uso de doble cantidad de suero), la T y la globulina de fijación de hormonas sexuales (SHBG, por sus siglas en inglés) (Orion Diagnostica, Espoo, Finlandia), la leptina (Linco Research, St Charles, MO, EE.UU.), la IGF1 y la adiponectina (Diagnostic Systems Laboratories, Webster, TX, EE.UU.). Los CV intra e interensayos fueron 6 y 5%, 1,5 y 3,7%, 5,6 y 7% para leptina, IGF1 y adiponectina respectivamente. Los niveles de testosterona libre (FT, por sus siglas en inglés) y E2 libre (FE2, por sus siglas en inglés) se calcularon utilizando una ecuación validada basada en la ley de acción de masas (7). Los rangos de referencia normales para testosterona libre (4-25 ng/dl) y FE2 (0,19-1,19 pg/ml) se basan en las observaciones realizadas en 677 jóvenes sanos, utilizando la misma metodología (8). Para todas las variables hormonales consideradas, los valores de cada día de muestreo son la media del resultado de dos muestras obtenidas en un intervalo de 20 minutos.
Análisis de datos
Todas las variables fueron comprobadas para la normalidad de la distribución por la prueba de muestra única de Kolmogorov-Smirnov a fin un apropiado ajuste. A menos que se indique lo contrario, todas las variables se expresan como media GS.D. Las diferencias entre los grupos de edad para los valores de referencia se exploraron utilizando una prueba-t de Student independiente o la prueba U de Mann-Whitney en el caso de la distribución no gaussiana. Se utilizó la prueba-t de Student o la prueba de suma de pares de Wilcoxon de rango firmado para el análisis de los cambios de la línea de base de cada parámetro bioquímico. Todos los procedimientos estadísticos se realizaron utilizando el paquete de software SPSS 12.0 (SPSS Inc., Chicago, IL, EE.UU.) y se consideró que un valor P de !0,05 indicaba la significación estadística; todos los valores P eran bilaterales.
Resultados
Características iniciales
Los participantes de ambos grupos de edad tenían índices de masa corporal dentro del rango normal. No se observaron diferencias en el peso, los lípidos, la insulina, la glucosa, la leptina o los niveles de adiponectina en el examen entre los hombres jóvenes y los ancianos (datos no mostrados, todos PO0,1), excepto en los niveles de IGF1, que fueron más altos en el grupo de edad más joven (462 frente a 245 ng/ml, P<0,001). Los niveles medios de triglicéridos (TG) al inicio del estudio estaban en el rango bajo para la población general. Los valores hormonales de referencia han sido publicados previamente y no fueron diferentes entre ambos grupos, excepto por los niveles más altos de SHBG y los niveles más bajos de testosterona libre en los ancianos (7). No se observaron diferencias entre los sujetos de los subgrupos que comenzaron con el placebo o el letrozol para el índice de masa corporal (IMC), los niveles de esteroides sexuales u otras variables (no se muestran los datos).
Cambios después de 28 días de intervención con placebo versus letrozol
Los cambios después de 28 días de tratamiento con letrozol y placebo se enumeran en el cuadro 1.
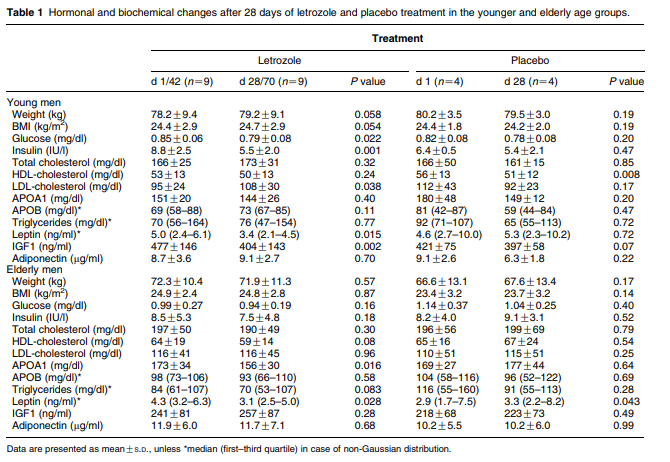
Durante la administración del placebo no se encontraron cambios en los niveles de esteroides sexuales o gonadotropinas (7), aunque sí se observó una disminución en los niveles de colesterol de lipoproteínas de alta densidad (HDL) en los más jóvenes y un ligero aumento en los niveles de leptina en los participantes de mayor edad. La administración de letrozol disminuyó los niveles de E2 (–41 y --62% en los grupos de edad joven y mayor respectivamente) y de SHBG (–18 y --15% respectivamente). En ambos grupos de edad se observó un aumento similar de los niveles de testosterona (T) (+128 y +99% respectivamente) y de gonadotropina (7). Después del tratamiento con letrozol, todos los participantes jóvenes y tres de cada diez participantes de edad avanzada tenían niveles de testosterona libre moderadamente superiores al valor inicial máximo, mientras que todos los participantes jóvenes y de edad avanzada tenían niveles de estradiol libre inferiores a los valores iniciales mínimos, como se observó en los hombres jóvenes sanos. En ambos grupos de edad no se observaron cambios significativos en el peso o el IMC. Los niveles de glucosa en plasma en ayunas disminuyeron modestamente (–7%) y, de manera constante, los niveles de insulina en ayunas disminuyeron en un 37% en los hombres jóvenes.
Sin embargo, cabe señalar que durante el tratamiento con placebo se observó una disminución similar, aunque no significativa, de los niveles de glucosa. En cambio, los parámetros del metabolismo de la glucosa no se alteraron significativamente en los ancianos. El perfil lipídico se deterioró en el grupo más joven, con un aumento del 14% en los niveles de lipoproteínas de baja densidad colesterol-(LDL) después de la intervención, lo que se reflejó en un aumento no significativo del APOB, el principal componente proteínico del colesterol-LDL. En los ancianos se observó una disminución del 10% en los niveles de APOA1, junto con una tendencia a la disminución de los niveles séricos de colesterol HDL. No se encontraron cambios significativos en los niveles de colesterol total o de TG. La inhibición de la aromatasa a corto plazo provocó una disminución de los niveles de IGF1 en el grupo más joven (–15%), mientras que no se observaron cambios en los ancianos. En cuanto a los niveles de leptina, se observaron marcadas disminuciones en ambos grupos de edad: los hombres jóvenes mostraron niveles de leptina 24% más bajos después del tratamiento activo, mientras que los niveles de leptina en los hombres de edad avanzada se redujeron en un 25%. Los niveles de adiponectina no se alteraron significativamente por nuestra intervención.
La inhibición de la aromatasa a corto plazo provocó una disminución de los niveles de IGF1 en el grupo más joven (–15%).
Discusión
Este estudio muestra que los cambios hormonales inducidos por la inhibición de la aromatasa tienen efectos modestos pero significativos a corto plazo en los parámetros del metabolismo de la glucosa y los lípidos, con algunas diferencias aparentes entre los hombres jóvenes y los de edad avanzada. En los hombres jóvenes, la inhibición de la aromatasa dio lugar a niveles presumiblemente más bajos de glucosa en ayunas, y a niveles notablemente más bajos de insulina y de IGF1. Estos hallazgos se corroboran con los de Wickman y otros, que informaron de una disminución de los niveles de insulina, en correlación con los cambios en los niveles de IGF1, en niños tratados a largo plazo con testosterona más letrozol (9). En cambio, la administración de letrozol durante dos años a niños peripubertales más jóvenes no mejoró la sensibilidad a la insulina (HOMA) (10). En concordancia con los resultados obtenidos en los hombres de edad, Dougherty y otros no encontraron cambios en la sensibilidad a la insulina (HOMA) en los hombres de edad con hipogonadismo leve después de 12 semanas de inhibición de la aromatasa (anastrozol 1 mg al día o 2 mg semanales) (11). Aunque Wickman y otros (9) y Hero y otros (10) informaron que los niveles de colesterol HDL habían disminuido en sus pacientes, no se observaron cambios en los niveles de colesterol LDL y Dougherty y otros no encontraron cambios en los niveles lipídicos (11). En otro estudio, la administración de testolactona durante seis semanas (4.250 mg diarios) a hombres adultos disminuyó las concentraciones de HDL y APOA1 (12), lo que parece coincidir con nuestras observaciones en hombres de edad avanzada. Junto con nuestros datos, estas observaciones podrían sugerir que los efectos a corto plazo de la inhibición de la aromatasa en el metabolismo de la glucosa y los lípidos podrían deberse a los efectos en el metabolismo de la GH y la IGF1, ya que se sabe que los estrógenos endógenos estimulan la secreción de estas hormonas (13) y los efectos de la IGF1 en el metabolismo de la glucosa están bien establecidos (14). Esto también podría explicar los efectos discrepantes de la inhibición de la aromatasa en los hombres jóvenes frente a los ancianos, ya que se sabe que el metabolismo de la IGF1 disminuye con el envejecimiento (15). Sin embargo, la administración durante 10 semanas de anastrozol (1 mg/día) a ocho hombres sanos no afectó los niveles de insulina, glucosa o lípidos, a pesar de la disminución de las concentraciones de IGF1 (16), ni tampoco se vieron afectados los niveles de lípidos en otro estudio (17). A este respecto, las posibles diferencias entre los estudios podrían explicarse por la mayor potencia inhibitoria de la aromatasa del letrozol en comparación con el anastrozol (18).
Sin embargo, no se pueden excluir los efectos específicos de la edad, ya que a pesar de los cambios similares en ambos grupos de edad después de la intervención activa, los hombres más jóvenes presentaron niveles absolutos más altos de testosterona libre y estradiol2 libre en comparación con los hombres mayores, tanto antes como después del tratamiento y en concordancia con los conocidos cambios relacionados con la edad en los niveles de esteroides sexuales. Además, hay pruebas de una disminución del número de receptores de andrógenos, y por lo tanto de la sensibilidad a los andrógenos, en diversos tejidos en los hombres de edad avanzada (5). En conjunto, los efectos específicos de la edad pueden explicar, al menos en parte, nuestros hallazgos divergentes entre los hombres jóvenes y los de edad avanzada. Aunque se podría sospechar de los efectos directos de los esteroides sexuales en las células b pancreáticas (19, 20), otra posible explicación de nuestros hallazgos podría ser que la inhibición de la aromatasa en los hombres altera la estrategia oxidativa del cuerpo, favoreciendo la grasa sobre la oxidación de la glucosa. Esto podría deberse a la inhibición de la actividad de la lipoproteína lipasa, inhibiendo así la captación de TG y acelerando la liberación de TG del tejido adiposo abdominal (21). Aunque esto podría explicar los bajos niveles de glucosa e insulina en ayunas, no observamos cambios significativos en los niveles de TG en plasma en ayunas. Tanto en los hombres jóvenes como en los ancianos, observamos un marcado descenso en los niveles de leptina después de la inhibición de la aromatasa. Aunque una sola dosis del inhibidor de la aromatasa MPV 2213ad no mostró efectos en los niveles séricos de leptina en hombres jóvenes (22), nuestros hallazgos coinciden con las observaciones en personas transexuales hombre-mujer tratadas hormonalmente (23) y en hombres jóvenes tratados con TG (24). Además, a pesar de las asociaciones transversales entre T y los niveles de adiponectina (25) y los cambios en los niveles de adiponectina después de la modulación de los niveles de esteroides sexuales (10, 26, 27) que sugieren una influencia de los esteroides sexuales en la producción de adiponectina, no se observaron cambios significativos en los niveles de adiponectina en nuestro estudio.
Sin embargo, como la testosterona parece afectar principalmente a la fracción de alto peso molecular de la adiponectina (27), que no se midió específicamente en nuestro ensayo, es posible que pasáramos por alto algunos cambios. Otra posible explicación de los efectos divergentes de la inhibición de la aromatasa sobre los niveles de leptina frente a los de adiponectina podría ser que los esteroides sexuales influyen en la secreción de leptina por medio de efectos hipotalámicos centrales o b-adrenérgicos, mientras que la secreción de adiponectina podría verse afectada preferiblemente por las alteraciones del tamaño y/o el número de adipocitos. Además, la leptina se segrega principalmente de los adipocitos subcutaneos (28), mientras que la adiponectina resulta principalmente de los adipocitos viscerales (29), y se han notificado efectos divergentes de los esteroides sexuales en diferentes depósitos de grasa (21). Aunque no se puede concluir a partir de nuestro estudio que el cambio del entorno de los esteroides sexuales afecta al metabolismo de la glucosa, los lípidos y la leptina independientemente de los cambios en la composición corporal, la duración relativamente corta de nuestra intervención no permitiría grandes cambios en la masa grasa y/o muscular, y no se observaron cambios significativos en el peso corporal o el IMC en ninguno de los dos grupos. Desafortunadamente, esto no pudo ser confirmado por mediciones más precisas de la composición corporal. Como apoyo, sin embargo, un ensayo realizado por Mauras y otros, no informó de cambios en la composición corporal o en el anabolismo corporal completo después de 10 semanas de inhibición de la aromatasa (16), a pesar de los cambios similares en los niveles de esteroides sexuales que se observaron en nuestro estudio. Por lo tanto, nuestros resultados sugieren efectos directos de los esteroides sexuales en el metabolismo de la glucosa, los lípidos y la leptina. Además, se ha demostrado que la abstinencia aguda de esteroides sexuales en hombres hipogonadales reduce la sensibilidad a la insulina independientemente de los cambios en la composición corporal (30). Las limitaciones de nuestro estudio son, obviamente, el pequeño tamaño de la muestra y el prominente efecto de remanencia en la segunda fase del placebo, que no nos permitió comparar los cambios durante la administración del letrozol frente al placebo. Además, como la inhibición de la aromatasa afecta tanto a los niveles de E2 como de T, es imposible evaluar si los cambios observados se deben a una mayor acción androgénica frente a una acción estrogénica atenuada. Por último, durante el tratamiento con placebo se observaron algunos cambios aleatorios significativos, aunque probablemente falsos. En resumen, la inhibición de la aromatasa a corto plazo con letrozol 2,5 mg diarios afectó el metabolismo de la glucosa en hombres jóvenes, pero no ancianos, y redujo los niveles de leptina en ambos grupos de edad. Debido a la corta duración de nuestra intervención, estos efectos parecen ser independientes de los cambios en la composición corporal. Sin embargo, es necesario seguir investigando si estos efectos son realmente directos debido a la acción de los esteroides sexuales, modulados por la edad, reproducibles en diferentes poblaciones y por cambios dentro del rango fisiológico normal o después de una intervención aún más breve.
Referencia y Bibliografia
Declaración de interés
Todos los autores no tienen nada que divulgar, excepto el generoso regalo de tabletas de letrozol (Femaraw) de Novartis, Departamento de Oncología, Bélgica.
Financiamiento
Esta investigación no recibió ningún subsidio específico de ningún organismo de financiación del sector público, comercial o sin fines de lucro.
Agradecimientos
Estamos en deuda con Kaatje Toye, Anne-Marie Hutse y Els Feyen por la meticulosa realización del protocolo de estudio y con Inge Bocquaert y Kathelijne Mertens por la realización de los inmunoensayos. Agradecemos a todos los voluntarios que participaron como sujetos de estudio. También estamos en deuda con Novartis, Departamento de Oncología, Bélgica, por el generoso regalo de las tabletas de letrozol (Femara).
Short-term aromatase inhibition: effects on glucose metabolism
and serum leptin levels in young and elderly men
B Lapauw, G T’Sjoen, A Mahmoud, J M Kaufman and J B Ruige
Department of Endocrinology, 9K12 I.E., Ghent University Hospital, De Pintelaan 185, 9000 Ghent, Belgium
European Journal of Endocrinology (2009) 160 397–402 ISSN 0804-4643
References
1 Leder BZ, Rohrer JL, Rubin SD, Gallo J & Longcope C. Effects of aromatase inhibition in elderly men with low or borderline-low serum testosterone levels. Journal of Clinical Endocrinology and Metabolism 2004 89 1174–1180.
2 de Boer H, Verschoor L, Ruinemans-Koerts J & Jansen M. Letrozole normalizes serum testosterone in severely obese men with hypogonadotropic hypogonadism. Diabetes, Obesity and Metabolism 2005 7 211–215.
3 Loves S, Ruinemans-Koerts J & de Boer H. Letrozole once a week normalizes serum testosterone in obesity-related male hypogona-dism. European Journal of Endocrinology 2008 158 741–747.
4 de Ronde W. Therapeutic uses of aromatase inhibitors in men. Current Opinion in Endocrinology, Diabetes and Obesity 2007 14 235–240.
5 Kaufman JM & Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocrine Reviews 2005 26 833–876.
6 Cohen PG. Aromatase, adiposity, aging and disease. The hypogonadal-metabolic-atherogenic-disease and aging connec-tion. Medical Hypotheses 2001 56 702–708.
7 T’Sjoen GG, Giagulli VA, Delva H, Crabbe P, De Bacquer D & Kaufman JM. Comparative assessment in young and elderly men of the gonadotropin response to aromatase inhibition. Journal of Clinical Endocrinology and Metabolism 2005 90 5717–5722.
8 Bogaert V, Taes Y, Konings P, Van Steen K, De Bacquer D, Goemaere S, Zmierczak H, Crabbe P & Kaufman JM. Heritability of blood concentrations of sex-steroids in relation to body compo-sition in young adult male siblings. Clinical Endocrinology 2008 69 129–135.
9 Wickman S, Saukkonen T & Dunkel L. The role of sex steroids in the regulation of insulin sensitivity and serum lipid concentrations during male puberty: a prospective study with a P450-aromatase inhibitor. European Journal of Endocrinology 2002 146 339–346.
10 Hero M, Ankarberg-Lindgren C, Taskinen MR & Dunkel L. Blockade of oestrogen biosynthesis in peripubertal boys: effects on lipid metabolism, insulin sensitivity, and body composition. European Journal of Endocrinology 2006 155 453–460.
11 Dougherty RH, Rohrer JL, Hayden D, Rubin SD & Leder BZ. Effect of aromatase inhibition on lipids and inflammatory markers of cardiovascular disease in elderly men with low testosterone levels. Clinical Endocrinology 2005 62 228–235.
12 Bagatell CJ, Knopp RH, Rivier JE & Bremner WJ. Physiological levels of estradiol stimulate plasma high density lipoprotein2 cholesterol levels in normal men. Journal of Clinical Endocrinology and Metabolism 1994 78 855–861.
13 Metzger DL & Kerrigan JR. Estrogen receptor blockade with tamoxifen diminishes growth hormone secretion in boys: evidence for a stimulatory role of endogenous estrogens during male adolescence. Journal of Clinical Endocrinology and Metabolism 1994 79 513–518.
14 Clemmons DR. Roles of insulin-like growth factor-I and growth hormone in mediating insulin resistance in acromegaly. Pituitary 2002 5 181–183.
15 Ceda GP, Dall’Aglio E, Maggio M, Lauretani F, Bandinelli S, Falzoi C, Grimaldi W, Ceresini G, Corradi F, Ferrucci L, Valenti G & Hoffman AR. Clinical implications of the reduced activity of the GH–IGF-I axis in older men. Journal of Endocrinological Investigation 2005 28 96–100.
16 Mauras N, O’Brien KO, Klein KO & Hayes V. Estrogen suppression in males: metabolic effects. Journal of Clinical Endocrinology and Metabolism 2000 85 2370–2377.
17 Lew R, Komesaroff P, Williams M, Dawood T & Sudhir K. Endogenous estrogens influence endothelial function in young men. Circulation Research 2003 93 1127–1133.
18 Geisler J, Haynes B, Anker G, Dowsett M & Lonning PE. Influence of letrozole and anastrozole on total body aromatization and plasma estrogen levels in postmenopausal breast cancer patients evaluated in a randomized cross-over study. Journal of Clinical Oncology 2002 20 751–757.
19 Ropero AB, Alonso-Magdalena P, Quesada I & Nadal A. The role of estrogen receptors in the control of energy and glucose homeostasis. Steroids 2008 73 874–879.
20 Grillo ML, Jacobus AP, Scalco R, Amaral F, Rodrigues DO, Loss ES & Wassermann GF. Testosterone rapidly stimulates insulin release from isolated pancreatic islets through a non-genomic dependent mechanism. Hormone and Metabolic Research 2005 37 662–665.
21 Marin P, Oden B & Bjorntorp P. Assimilation and mobilization of triglycerides in subcutaneous abdominal and femoral adipose tissue in vivo in men: effects of androgens. Journal of Clinical Endocrinology and Metabolism 1995 80 239–243.
22 Luukkaa V, Rouru J, Ahokoski O, Scheinin H, Irjala K & Huupponen R. Acute inhibition of oestrogen biosynthesis does not affect serum leptin levels in young men. European Journal of Endocrinology 2000 142 164–169.
23 Elbers JMH, Asscheman H, Seidell JC, Frolich M, Meinders AE & Gooren LJG. Reversal of the sex difference in serum leptin levels upon cross-sex hormone administration in transsexuals. Journal of Clinical Endocrinology and Metabolism 1997 82 3267–3270.
24 Luukkaa V, Pesonen U, Huhtaniemi I, Lehtonen A, Tilvis R, Tuomilehto J, Koulu M & Huupponen R. Inverse correlation between serum testosterone and leptin in men. Journal of Clinical Endocrinology and Metabolism 1998 83 3243–3246.
25 Lanfranco F, Zitzmann M, Simoni M & Nieschlag E. Serum adiponectin levels in hypogonadal males: influence of testosterone replacement therapy. Clinical Endocrinology 2004 60 500–507.
26 Lanfranco F, Zitzmann M, Simoni M & Nieschlag E. Serum adiponectin levels in hypogonadal males: influence of testosterone replacement therapy. Clinical Endocrinology 2004 60 500–507.
27 Xu A, Chan KW, Hoo RLC, Wang Y, Tan KCB, Zhang J, Chen B, Lam MC, Tse C, Cooper GJS & Lam KSL. Testosterone selectively reduces the high molecular weight form of adiponectin by inhibiting its secretion from adipocytes. Journal of Biological Chemistry 2005 280 18073–18080.
28 Gottschling-Zeller H, Birgel M, Scriba D, Blum WF & Hauner H. Depot-specific release of leptin from subcutaneous and omental adipocytes in suspension culture: effect of tumor necrosis factor-alpha and transforming growth factor-beta1. European Journal of Endocrinology 1999 141 436–442.
29 Motoshima H, Wu X, Sinha MK, Hardy VE, Rosato EL, Barbot DJ, Rosato FE & Goldstein BJ. Differential regulation of adiponectin secretion from cultured human omental and subcutaneous adipocytes: effects of insulin and rosiglitazone. Journal of Clinical Endocrinology and Metabolism 2002 87 5662–5667.