INTRODUCCIÓN
Frecuentemente hay un conflicto inherente en los campos superpuestos de fertilidad masculina y andrología. Si bien el objetivo de todos los especialistas en fertilidad masculina es facilitar y preservar la paternidad biológica, muchos profesionales también se enfocan en el manejo de un importante número de pacientes que sufren de hipogonadismo. La administración exógena de testosterona, la cual es el tratamiento estándar para el manejo de estos pacientes, perjudica de forma casi universal la espermatogénesis y puede incluso erradicarla por completo en algunos hombres. Con el constante incremento en la incidencia de hipogonadismo y de la edad paterna media, los profesionales ahora encuentran con frecuencia hombres con hipogonadismo que desean fertilidad en el futuro u hombres sufriendo los efectos de una temprana terapia con esteroides anabólicos androgénicos. En este manuscrito, revisamos las estrategias de manejo para estos complejos pacientes y exploramos nuevos medicamentos que podrían ser útiles en esta población.
El funcionamiento fisiológico de los testículos es esencial para la fertilidad masculina y el desarrollo de características sexuales masculinas secundarias [1].
En los hombres, los propósitos primarios de los testículos se pueden resumir como:
- La producción de testosterona y
- espermatogénesis
Estas funciones criticas se coordinan a través de una compleja sinfonía de señalización hormonal conocida como el eje hipotalámico pituitario gonadal (HPG). Cualquier desregulación de esta vía puede conducir al hipogonadismo masculino, a la infertilidad o a una combinación de ambos, el hipogonadismo masculino es una entidad clínica caracterizada por bajos niveles séricos de testosterona en conjunto con síntomas sistémicos que incluyen fatiga, disfunción eréctil y cambios de humor [2]. También acarrea conocidos riesgos cardiovasculares y metabólicos [3,4]. La infertilidad por factor masculino se define como la incapacidad de concebir después de 12 meses de relaciones sexuales sin protección. Esta incapacidad para establecer un embarazo casi siempre es vista en conjunto con parámetros anormales de análisis de semen (AS) pero a veces puede estar presente aun cuando estos valores se encuentran normales. Tanto la incidencia del hipogonadismo masculino como la infertilidad por factor masculino han aumentado de forma notable en los últimos años, esto obliga los proveedores de atención medica a expandir su armamento cuando se refiere a la evaluación y tratamiento de estas patologías [7-9].
La testosterona, el prototipo de esteroide anabólico androgénico (EAA), fue aislado caracterizado y sintetizado por primera vez en 1935 [10, 11]. Poco tiempo después de su introducción, investigadores notaron su habilidad para estimular el crecimiento muscular y el interés creció en sus potenciales aplicaciones para uso supra terapéutico y rendimiento deportivo.
Estos efectos fueron mas popularizados por el autor Paul de Kruif en su libro de 1945, “La hormona masculina” [10]. Los primeros usos documentados de EAA en el deporte competitivo incluyen el equipo alemán de remo de 1952 y el equipo ruso de levantamiento de pesas de 1954 [12]. La adopción difundida ampliamente entre los atletas olímpicos impulso al Comité Olímpico Internacional (COI) a iniciar programas de detección del EAA y sus derivados en la década de 1960 [13]. El uso de EAA fue explícitamente prohibido a partir de 1967 y en 1999 se estableció la Agencia Mundial Antidopaje para ayudar al COI en la lucha contra el dopaje ilícito [14]. A pesar de estos esfuerzos, el uso de EAA sigue siendo una practica frecuente en todo el deporte y, en los últimos años, ha sido adoptado cada vez más por hombres jóvenes que no son atletas profesionales, sino que simplemente desean mejorar su físico [15]. Desde la síntesis original de la testosterona, se han desarrollado varios otros medicamentos que también utilizan el eje HPG. La gonadotropina coriónica humana (HCG), un análogo directo de la hormona luteinizante (LH), ha demostrado estimular la producción de testosterona por las células de Leydig [16]. El citrato de clomifeno (CC) es un conocido modulador selectivo de los receptores de estrógeno (SERM, por sus siglas en ingles) de acción central que actúa inhibiendo la retroalimentación negativa del estrógeno en el hipotálamo. Probablemente el medicamento mas utilizado en la fertilidad masculina, el CC ha demostrado aumentar la LH sérica, la hormona folículo estimulante (FSH), y los niveles de testosterona endógena, mientras que preserva e incluso mejora potencialmente los parámetros del AS [17]. El tamoxifeno, otro SERM, posee un mecanismo de acción similar [18].
MECANISMOS DE ACCIÓN
1. Testosterona
La testosterona es la principal hormona sexual masculina y el EAA original. Esta funciona penetrando la membrana celular de la célula objetivo y uniéndose a una molécula intracitosólica conocida como el receptor de andrógenos (AR) . Este complejo se reubica en el núcleo donde forma un homodimero que luego interactúa con un elemento de respuesta androgénica en los genes objetivo, aumentando la transcripción de genes y la síntesis de proteínas [19].
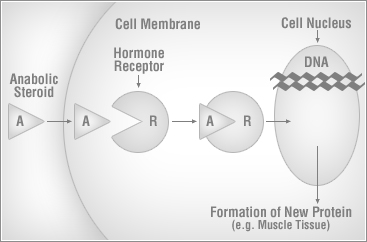
Esto resulta en una cascada de efectos que se pueden ver en todo el cuerpo. Los efectos de la testosterona pueden clasificarse a grandes rasgos en uno de los dos subtipos: androgénicos y anabólicos. Los efectos androgénicos de la testosterona incluyen aquellos tradicionalmente asociados con la virilización, como los efectos en el tracto reproductivo, el crecimiento del cabello y la actividad de las glándulas sebáceas.
Estos efectos están más comúnmente correlacionados con la pubertad masculina. Los efectos anabólicos de la testosterona incluyen el aumento de la fijación de nitrógeno, la síntesis de colágeno, el crecimiento muscular y le metabolismo óseo, con una actividad osteoblástica neta [20]. La testosterona es sintetizada por las células de Leydig de los testículos como producto final de una elegante serie de interacciones hormonales conocidas colectivamente como el eje HPG [21]. El hipotálamo, localizado en el cerebro anterior, secreta la hormona liberadora de gonadotropina en forma pulsátil, la cual viaja a través del sistema hipofisario-portal para alcanzar la glándula pituitaria anterior [22]. En respuesta a este estimulo, la glándula pituitaria anterior secreta tanto FSH como LH. Las FSH actúa sobre las células de Sertoli de los testículos para facilitar la espermatogénesis mientras que la HL actúa sobre las células de Leydig para estimular la producción de testosterona. Esto resulta en concentraciones intra testiculares impresionantemente altas de testosterona que son esenciales para la producción de espermatozoides y aproximadamente ~x40 niveles séricos [16]. El resto de la testosterona se libera de forma sistémica y ejerce los efectos fisiológicos detallados previamente.
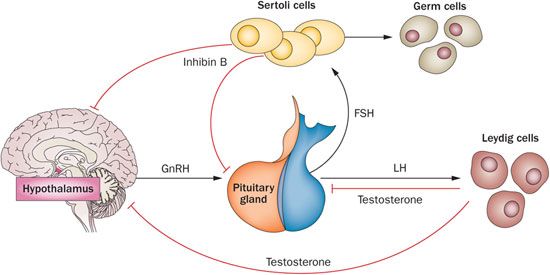
Los efectos perjudiciales de la testosterona exógena en la reproducción masculina se deben a la alteración del eje HPG masculino descrito anteriormente y a las consiguientes disminuciones tanto de la FSH como de la LH séricas [23]. Sin la estimulación apropiada de la FSH, las células de Sertoli se vuelven incapaces de soportar la espermatogénesis, mientras que niveles inferiores de LH provocan una disminución de la producción de testosterona endógena por parte de las células de Leydig.
Aunque los niveles séricos de testosterona se mantienen con la administración exógena, los niveles intra testiculares apropiados de testosterona sólo pueden lograrse mediante la producción endógena y son esenciales para una espermatogénesis normal [16]. En consecuencia, la testosterona exógena conduce casi universalmente a una baja testosterona intra testicular con la consiguiente atrofia del epitelio germinal y la subsiguiente azoospermia en más del 40% de los hombres [24]. Aunque la mayoría de los hombres eventualmente experimentarán un retorno de espermatozoides al eyacular después de dejar de usar testosterona, la restauración completa de la fertilidad previa es incierta [25,26]. Incluso con la terapia adjunta, hasta el 30% de los hombres previamente azoospérmicos pueden fallar en alcanzar un conteo móvil total mayor a 5 millones [25].
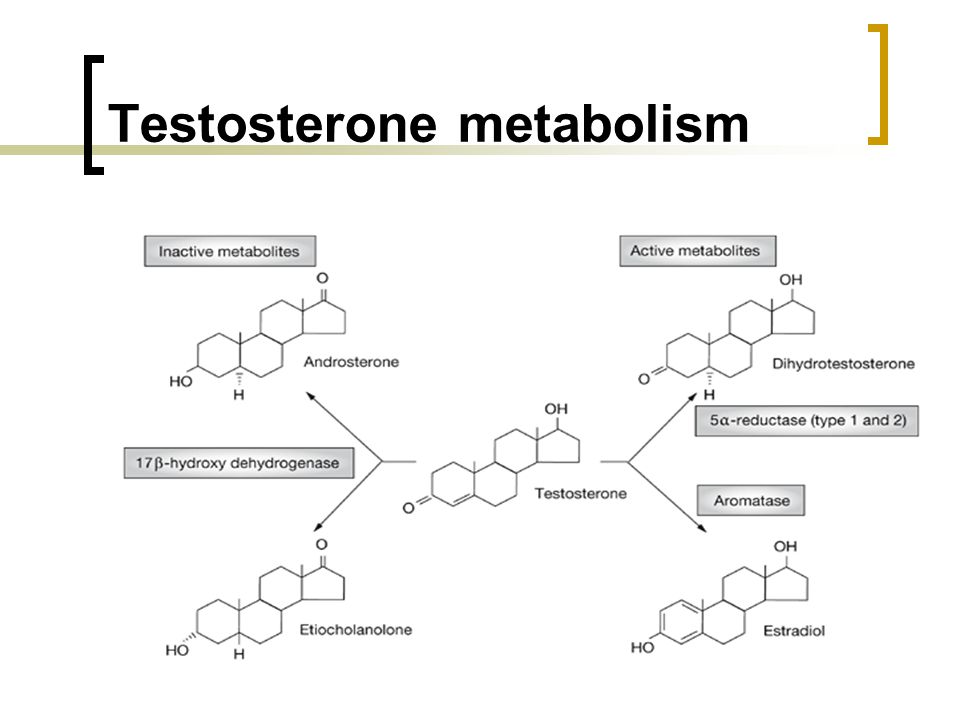
Una vez liberada en el suero, la testosterona puede sufrir diferentes destinos metabólicos, con una parte convertida en 17β-estradiol a través de la enzima aromatasa y otra en la potente dihidrotestosterona (DHT) andrógina a través de 5α-reductasa. Una cantidad significativa de aromatasa se encuentra dentro del tejido adiposo, lo que lleva al aumento de los niveles de 17β-estradiol que se observa a menudo en los hombres obesos [27,28]. Este exceso de estrógeno está asociado con la ginecomastia, la retención de líquidos, la disfunción sexual y un mayor riesgo de tromboembolismo. La DHT, por otro lado, tiene una afinidad 3 veces mayor con el receptor de andrógenos. Los estudios han demostrado que esto es esencial para la normalidad de la libido y la función eréctil, pero también se sabe que contribuye a los efectos secundarios androgénicos indeseables, como el acné, la alopecia y la hiperplasia prostática benigna [29].
Los niveles séricos normales de testosterona en el hombre adulto oscilan entre 300 y 1.000 ng/dL, con una producción fisiológica normal de testosterona que oscila entre 2,1 y 11,0 mg por día [24]. Hay una disminución relacionada con la edad en los valores séricos totales de testosterona, lo que resulta en una mayor incidencia de hipogonadismo en la población de edad avanzada [30]. Por el contrario, los hombres más jóvenes pueden experimentar síntomas clínicos de hipogonadismo a pesar de tener valores “normales” de testosterona sérica total, aunque en el rango más bajo [31]. Los niveles de testosterona tienden a seguir un ritmo circadiano natural con valores que aumentan por la mañana, lo que hace que las pruebas matutinas sean esenciales para una medición precisa [32].
2. Esteroides anabólicos androgénicos
Los EAA funcionan a través de un mecanismo de acción casi idéntico al de la testosterona. Sus rasgos definitorios se derivan de sus efectos anabólicos preferentes y del subsiguiente metabolismo [33]. Como forma de evaluar la potencia relativa de los EAA, Eisenberg y Gordan propusieron en 1950 un novedoso “índice miotrófico-androgénico (MA)” que compara los efectos anabólicos y androgénicos relativos de los EAA. Esto se llevó a cabo midiendo el peso del músculo elevador del ano de ratas y comparándolo con el peso de la vesícula seminal después de la suplementación androgénica exógena. A la testosterona, como el EAA original, se le asignó un índice MA de 1:1 [24]. En comparación, el EAA sintético muestra proporciones de MA mucho más favorables.
En comparación, los EAA sintéticos muestran proporciones de MA mucho más favorables. Por ejemplo, la nandrolona compuesta posee un índice de MA de 11:1 mientras que la oxandrolona, otro EAA, muestra un índice de 10:1 [33]. Como resultado, estos compuestos muestran un potencial miogénico exponencialmente mayor que su molécula madre con menos efectos secundarios androgénicos. Desafortunadamente, como todos los EAA, todavía interrumpen el eje normal de HPG de una manera idéntica a la testosterona exógena. Con respecto al potencial de disfunción testicular, la amenaza que supone el uso de EAA para la futura fertilidad y la correcta función de las células de Sertoli y Leydig no puede ser desestimada. Múltiples estudios han documentado el hipogonadismo a largo plazo derivado del uso previo de EAA [23,34]. Una encuesta en particular demostró que el principal arrepentimiento entre los usuarios previos de EAA fue no entender las potenciales ramificaciones que su uso de EAA podía tener en la fertilidad futura [35]. Muchos usuarios de EAA intentan mitigar este riesgo organizando su uso de EAA en “ciclos” con períodos dedicados de “terapia post-ciclo” en los que utilizan medicamentos como la CC para estimular la función testicular nativa. Desafortunadamente, no ha habido estudios que documenten la eficacia de esto. Aunque se ha demostrado que el fracaso testicular por el uso previo de EAA es tratable en la gran mayoría de los casos, el éxito no está garantizado y los hombres que desean una fertilidad futura deben ser advertidos al respecto [23,34,36].
Aunque fuera del marco de este trabajo, los efectos adversos de los EAA se extienden mucho más allá del sistema reproductivo. Éstos son de amplio alcance y abarcan los sistemas cardíaco, hepático, renal, musculoesquelético, endocrino y hematopoyético, entre otros [33,37-40]. El reto de estudiar los efectos adversos de los EAA es que se han realizado muy pocos ensayos clínicos que estudien las consecuencias de estos compuestos en los seres humanos [41-49]. La mayoría de los estudios en que se han comunicado los efectos adversos de los EAA han sido de carácter retrospectivo y anecdótico, sin estandarización de las sustancias o los regímenes de dosificación utilizados previamente [39,49]. El estudio de la prevalencia del uso de EAA se ha visto a menudo obstaculizado por la palabra “esteroide”, al confundir el uso de corticoesteroides prescritos con el uso de EAA autoadministrados. Esto ha resultado en estimaciones variadas del uso de EAA no prescritos que van desde el 6,6% de los hombres en el último año de secundaria hasta el 7,3% de las mujeres en la escuela media [50,51]. Una revisión más rigurosa que abarca varios estudios recientes estima que entre 2,9 y 4 millones de estadounidenses de 13 a 50 años han utilizado EAA al menos una vez. Los investigadores encontraron que la edad media del primer uso de EAA fue de 22 años y que sólo el 13,1% de los usuarios había comenzado antes de los 18 años. Se estimó que menos del 1% eran mujeres [52].
3. Gonadotropina coriónica humana (HCG)
La HCG fue identificada por primera vez en la sangre y la orina de mujeres embarazadas por Aschheim y Zondek en 1927 [53]. Ellos plantearon la hipótesis de que esta sustancia provenía de la pituitaria anterior y demostraron que inyectarla subcutáneamente en ratones femeninos inmaduros intactos produjo maduración folicular, luteinización y hemorragia en el estroma ovárico. Trabajos posteriores de Seegar-Jones y otros [54] demostraron que esta sustancia no provenía de la pituitaria, sino de las vellosidades coriónicas de la placenta. Fue durante esa época que el término HCG fue utilizado por primera vez. La empresa holandesa Organon señaló sus similitudes de acción con la LH y comenzó a comercializarla como “Pregnon” en 1931 [55]. Debido a la similitud con otra marca, su nombre fue cambiado a “Pregnyl” en 1932 y permanece en el mercado hasta el día de hoy bajo este mismo nombre. El uso de la HCG en los hombres fue estudiado posteriormente desde 1950 y ha demostrado desde entonces que eleva eficazmente los niveles de testosterona endógena [56,57].
Un estudio reciente demostró que los hombres con hipogonadismo tratados con monoterapia con HCG experimentaron un aumento de testosterona sérica de aproximadamente ~250 ng/dL con una mejora aceptable de los síntomas del hipogonadismo [57]. Un beneficio adicional de la HCG es que actúa directamente sobre el testículo, provocando una respuesta rápida en relación con los medicamentos indirectos como la CC (clomifeno citrato) que dependen de la síntesis pituitaria de la LH. Es por esta razón que la terapia con HCG se ha convertido en una piedra angular en el tratamiento de la fertilidad masculina. Desafortunadamente, su costo, la vía de administración subcutánea y su relativamente corta vida media (33 horas) impiden que sea utilizada por la mayoría de los pacientes con hipogonadismo como terapia principal [58].
4.Citrato de clomifeno (CC) y tamoxifeno (SERMS)
El desarrollo de Citrato de clomifeno es un ejemplo clásico de cooperación entre la industria y el mundo académico, donde cada parte ofrece una contribución igual [59]. En 1956, mientras trabajaba en la William S. Merrell Chemical Company, un equipo dirigido por el químico Frank P. Palopoli desarrolló por primera vez el compuesto que se conocería como Citrato de clomifeno. Se llevaron a cabo múltiples estudios en animales y se notaron los obvios efectos hormonales y ovulatorios del Citrato de clomifeno [59]. Se postuló entonces que el Citrato de clomifeno podría ayudar a la inducción de la ovulación y los primeros ensayos en humanos fueron reportados posteriormente en 1961 [60].
Poco después de esto, el uso de Citrato de clomifeno se probó en sujetos varones y se encontró que elevaba tanto las gonadotropinas como los parámetros del análisis de semen (AS) en hombres oligospérmicos [61,62]. Desde entonces, la CC se ha convertido en la droga más prescrita en el campo de la infertilidad. El mecanismo de acción del clomifeno ha sido bien descrito [59]. Un SERM, el clomifeno funciona inhibiendo el ciclo de retroalimentación negativa del estrógeno en el hipotálamo.
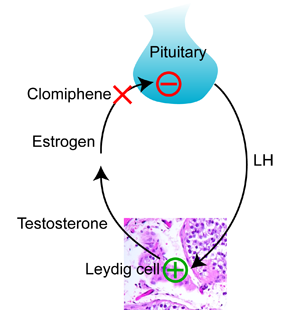
Esto estimula la producción de gonadotropina y por consiguiente promueve la función testicular [17,59]. El tamoxifeno, otro SERM, tiene un mecanismo de acción similar [63]. Curiosamente, a pesar de ser más conocido por su uso en el cáncer de mama, el tamoxifeno se sintetizó inicialmente como un anticonceptivo potencial en 1962 en los laboratorios farmacéuticos del grupo químico británico ICI. Cuando se descubrió que realmente estimulaba la ovulación, como el clomifeno, se abandonó su desarrollo hasta que fue cooptado para su uso en el cáncer de mama en la década de 1980 [63]. A diferencia del CC, el tamoxifeno es bastante activo en la periferia, lo que permite su éxito en el tratamiento del cáncer de mama sensible a las hormonas. También ha demostrado ser un tratamiento efectivo para la ginecomastia de aparición temprana en los hombres [64]. Pero de manera similar al CC, se ha demostrado que eleva las gonadotropinas y mejora los parámetros del análisis de semen (AS) en hombres subfértiles [65].
RECUPERACIÓN DE LA FERTILIDAD DESPUES DEL PREVIO USO DE ESTEROIDES ANABÓLICOS ANDROGÉNICOS
Con ambos, el aumento de la edad paterna avanzada y la incidencia del hipogonadismo, cada vez más hombres se presentan para evaluaciones de fertilidad con antecedentes de terapia con testosterona (TTh, por sus siglas en ingles) y uso anterior o actual de EAA [66]. En un gran estudio poblacional retrospectivo de hombres en el Reino Unido que recibían TTh, se estimó que el 7% de los que buscaban asistencia para la infertilidad recibían TTh [67]. De todos los hombres que recibían TTh en este estudio, el 12% tenían entre 18 y 39 años y estaban en sus mejores años reproductivos. Por consiguiente, los profesionales deben familiarizarse con las maniobras y estrategias de gestión para restablecer la fertilidad de esos pacientes. Aunque se ha demostrado que el cese de la testosterona y los EAA por sí solos precipitan la recuperación de la espermatogénesis, este proceso suele ser prolongado, se asocia con la aparición abrupta de síntomas hipogonadales y con frecuencia constituye una carga significativa para las parejas. Liu y otros [68] demostraron en un análisis combinado de 30 estudios que examinaban la TTh como anticonceptivo hormonal a corto plazo que sólo el 67% de los hombres previamente eugonádicos recuperarían la espermatogénesis a los 6 meses. Para los hombres con una función testicular presuntamente deteriorada inicialmente, debido a un diagnóstico preexistente de hipogonadismo, no es descabellado suponer que su recuperación será aún más prolongada. Kohn y otros [25] demostraron que tanto la edad avanzada como el aumento de la duración de la TTh tienen efectos negativos en el tiempo de recuperación de la espermatogénesis.
En consecuencia, ha habido un creciente interés en el uso de la HCG para ayudar a acelerar la recuperación de estos pacientes. Wenker y otros [69] informaron por primera vez sobre el uso de la combinación de la HCG y la terapia de SERM para acelerar el retorno de los espermatozoides a la eyaculación en los hombres con antecedentes de uso de TTh y EAA en el 2015. Cuarenta y siete de 49 hombres con azoospermia u oligospermia grave experimentaron un retorno de espermatozoides al eyaculado o una mejora significativa de los parámetros de SA. Desde esa investigación inicial, el algoritmo de tratamiento propuesto por el autor ha sido refinado y racionalizado [18]. Como regla, todos los hombres que están tratando activamente de lograr un embarazo deben dejar de tomar testosterona o EAA inmediatamente. Esto puede incluir a los hombres que toman EAA sin prescripción o a los que reciben TTh por un historial establecido de hipogonadismo.
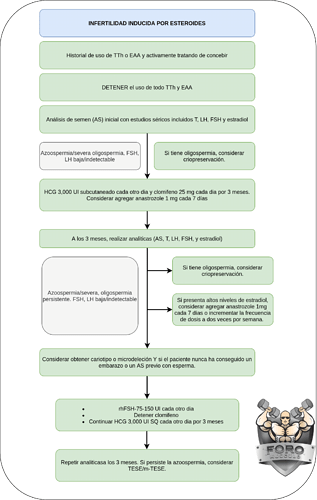
Estos hombres deben iniciar un régimen que consiste en 3.000 UI de HCG intramuscular o subcutánea cada dos días [18]. CC 25 a 50 mg VO (por os, por boca) diarios también deben ser incorporados para ayudar a promover la producción de FSH y la función pituitaria [69]. Durante este tiempo, deben obtenerse análisis de semen AS repetidos cada 2 o 3 meses junto con análisis de suero [70]. En la Fig. 1 se presenta un algoritmo de tratamiento detallado. A los hombres con oligospermia se les debe ofrecer la criopreservación cuando sea apropiado, mientras que a los hombres con azoospermia persistente a pesar del tratamiento y sin antecedentes de fertilidad o espermatozoides en AS se les debe realizar estudios genéticos para descartar una etiología preexistente fácilmente diagnosticable. Si no se logra el embarazo sin que los niveles de FSH o los parámetros de AS muestren una mejoría, se debe interrumpir el uso de clomifeno y añadir FSH recombinante de 75 a 150 UI en días alternos [18]. Si esto falla, se debe ofrecer la recuperación de esperma testicular con una posible microdisección junto con la fertilización in vitro como última oportunidad de paternidad biológica. Una vez logrado el embarazo, se puede discutir la reiniciación de TTh con especial consideración a los futuros objetivos de fertilidad.
TRATAMIENTO DE LA INFERTILIDAD INDUCIDA POR ESTEROIDES EXOGENOS
Fig. 1. Algoritmo para el tratamiento de la infertilidad inducida por esteroides. TTh: terapia con testosterona, EAA: esteroides androgénicos-anabólicos, AS: análisis de semen, T: testosterona, LH: hormona luteinizante, FSH: hormona estimulante de folículos, HCG: gonadotropina coriónica humana, SQ: subcutánea, QOD: QD: quaqua altera die (cada dos días), QD: quaque die (una vez al día), Q7 días: cada 7 días, rhFSH: hormona estimulante del folículo humano recombinante, TESE: extracción de espermatozoides testiculares, mTESE: microdisección de espermatozoides testiculares.
MANTENIMIENTO DE LA FETILIDAD CON USO SIMULTÁNEO DE TESTOSTERONA
Preservar la función testicular y la capacidad de reproducción sigue siendo un desafío permanente para los profesionales que prescriben TTh. Se sabe que la testosterona exógena disminuye la testosterona intratesticular y, por lo tanto, perjudica la espermatogénesis. De hecho, en 1996 la Organización Mundial de la Salud investigó las inyecciones semanales de 200 mg de enantato de testosterona (ET) como forma de anticoncepción. El grupo de trabajo demostró que el ET causaba azoospermia en aproximadamente el 75% de los hombres después de sólo 6 meses de uso [71]. Tanto la Asociación Urológica Americana como la Sociedad Endocrina publicaron directrices en 2018 que recomiendan no usar el ET en hombres que desean preservar la fertilidad [2,72]. La evidencia actual sugiere, sin embargo, que los medicamentos adyuvantes pueden ser prescritos en un esfuerzo por mantener la salud y la fertilidad testicular mientras se recibe TTh. Se ha demostrado que la coadministración de HCG con TTh ayuda a preservar la espermatogénesis en los hombres al mantener los niveles fisiológicos intratesticulares de testosterona a lo largo del tratamiento. En 2005, Coviello y otros [58] demostraron que el TTh hacía que los niveles de testosterona intratesticular disminuyeran en un 94% en hombres por lo demás sanos en edad reproductiva. Sin embargo, la adición subcutánea 250 IU de HCG cada dos días a su régimen de TTh evitó esta caída precipitada con los niveles de testosterona intratesticular sólo cayendo un 7% desde el punto de partida. Además, los hombres que recibieron TTh y 500 UI de HCG cada dos días en realidad experimentaron un aumento de su testosterona intratesticular en un 26% [58].
Este estudio demostró que la testosterona intratesticular podía mantenerse de forma fiable mientras se estaba en TTh. Futuros estudios demostrarían que la espermatogénesis en sí misma, y por lo tanto la fertilidad del varón, también podría perseverar durante la terapia. Un estudio retrospectivo publicado por Hsieh et al [73] en 2013 encontró que de 26 hombres tratados con TRT y HCG intramuscular de 500 UI día por medio, ningún paciente se volvió azoospérmico. Diecinueve de los 26 pacientes recibieron testosterona inyectable, mientras que siete fueron tratados con geles de testosterona transdérmicos. Los niveles hormonales séricos medios antes vs. durante el tratamiento fueron: testosterona 207,2 vs. 1.055,5 ng/dL (p<0,0001), testosterona libre 8,1 vs. 20,4 pg/mL (p=0,02). No se observaron diferencias en los parámetros del AS durante más de un año de seguimiento. Durante el seguimiento del estudio, nueve hombres lograron un embarazo con su pareja [73]. Este estudio continúa sirviendo como la base de los regímenes TTh “preservadores de la fertilidad” que se utilizan actualmente. Sensiblemente, todos los hombres que deseen preservar la fertilidad mientras están en TTh deben obtener un AS inicial de referencia. Durante la consulta inicial, también es importante identificar los objetivos de la paciente con respecto al momento del embarazo
Tabla 1. Resumen de las recomendaciones para el mantenimiento de la espermatogénesis con el uso de TTh o EAA
| Tiempo deseado del embarazo | Recomendaciones de tratamiento |
|---|---|
| <6 meses | Detener TTh/EAA. Iniciar 3,000 UI de HCG cada otro dia + citrato de clomifeno 25 mg diariamente AS y estudios de laboratorio cada 2 meses. Si no se tiene respuesta en los niveles de FSH, descontinuar clomifeno y agregar 75 UI de rhFSH un día de por medio |
| 6-12 meses | Continuar TTh/EAA. Continuar con 500 UI de HCG día de por medio ± citrato de clomifeno 25 mg diariamente |
12 meses|Continuar TTh/EAA. Continuar con 500 UI de HCG día de por medio. Si se inicia el tratamiento, obtener un AS inicial para referencia y comprobación de problemas de fertilidad ocultos
(Tabla 1). Si la paciente desea un embarazo dentro de los próximos 6 meses y aún no lo ha iniciado, debe abstenerse de iniciar la TTh hasta que el embarazo se haya logrado. Si desean el embarazo dentro de los 6 meses y ya están recibiendo TTh, se recomienda que detengan toda la TTh y sigan un régimen de recuperación idéntico al que se detalló en la sección anterior. Si se desea un embarazo planificado dentro de los 6 a 12 meses, los autores sugieren continuar TTh con HCG adyuvante de 500 UI cada dos días [18]. CC a una dosis de 25 mg por día debe considerarse una adición opcional durante todo este tiempo. Cuando se planifica un embarazo a más de un año de distancia, la TTh con HCG adyuvante de 500 UI puede ser continuada, pero los pacientes deben ser suspendidos cada seis meses dado el mayor riesgo de deterioro de la fertilidad con la TTh prolongada e ininterrumpida [25]. Cada ciclo de desconexión implica un ciclo de cuatro semanas de 3.000 UI de HCG cada dos días y 25 mg de CC diariamente. Durante cualquiera de estos regímenes anteriores, el anastrozol puede ser añadido y titulado en la dosis para hacer frente a cualquier elevación en el estradiol. Los pacientes que no pueden tolerar CC deben sustituir el tamoxifeno 10 mg dos veces al día. Muchos hombres que reciben TTh pueden no estar interesados en la fertilidad, pero aun así desean mantener un tamaño testicular normal. Se recomienda que estos individuos tomen 1.500 UI de HCG semanalmente mientras estén en TTh. Se cree que esta dosis es suficiente para mantener los niveles adecuados de testosterona intratesticular con el fin de minimizar la pérdida de volumen testicular. Algunos hombres sienten que periódicamente dejar de tomar TTh es sintomáticamente beneficioso, pero esta es una observación anecdótica y principalmente una cuestión de preferencia del paciente.
TTh: terapia con testosterona, EAA: esteroides anabólicos androgénicos, HCG: gonadotropina coriónica humana, AS: análisis de semen, FSH: hormona estimulante de folículos, rhFSH: hormona estimulante de folículos humanos recombinados.
CONCLUSIONES
Iniciar la terapia de reemplazo con testosterona requiere una discusión abierta y honesta entre el médico y el paciente. Los riesgos, beneficios, alternativas y expectativas deben ser revisados en detalle con un enfoque específico en las implicaciones reproductivas involucradas con el tratamiento. Mientras que muchos efectos secundarios de la TTh como el impacto cardiovascular siguen rodeados de controversia, los hallazgos de la disminución de la testosterona intratesticular y el subsiguiente deterioro de la producción de esperma están bien documentados. Afortunadamente, las maniobras mencionadas anteriormente se muestran prometedoras para mantener la salud testicular a lo largo del tratamiento, a la vez que facilitan la restauración exitosa de la fertilidad cuando se intenta un embarazo. Tanto el citrato de clomifeno como la HCG juegan un papel fundamental para ayudar a restaurar la espermatogénesis en estos hombres. Más estudios aleatorios y prospectivos son necesarios para dilucidar los programas de tratamiento más eficaces tanto durante como después del TTh. Mientras tanto, los hombres que consideran el TTh y que están interesados en preservar la fertilidad deben ser tratados por expertos familiarizados con las complejidades de estos regímenes médicos.
Otras articulos relacionados con el tema de la infertilidad y uso de esteroides anabolicos (ciclos, blast & cruise o TRT)
Review Article pISSN: 2287-4208 / eISSN: 2287-4690 World J Mens Health 2020 Apr 38(2): 141-150
Referencias, Autores, otros detalles
Declaración
Los autores no tienen ningún conflicto de intereses potencial que divulgar.
Contribución del autor
Conceptualización: todos los autores. Conservación de datos: AJT, JB. Análisis formal: todos los autores. Investigación: todos los autores. Metodología: todos los autores. Administración del proyecto: AJT, JB. Recursos: todos los autores. Software: todos los autores. Supervisión: AJT, JB. Validación: AJT, JB. Visualización: todos los autores. Borrador original de la escritura: todos los autores. Revisión de la escritura y edición: todos los autores.
Alexander J. Tatem 1 , Jonathan Beilan 1 , Jason R. Kovac 2 , Larry I. Lipshultz 1
1 Scott Department of Urology, Baylor College of Medicine, Houston, TX, 2 Men’s Health Center, Indianapolis, IN, USA
pISSN: 2287-4208 / eISSN: 2287-4690
World J Mens Health 2020 Apr 38(2): 141-150
https://doi.org/10.5534/wjmh.190002