Resumen
El uso de la terapia de reemplazo de testosterona (TRT) para el hipogonadismo sigue aumentando, en particular en los hombres más jóvenes quienes pueden desear seguir siendo fértiles. Simultáneamente, se ha observado un uso más generalizado de los esteroides anabólicos androgénicos (EAA) en la población general. Tanto la TRT como los EAA pueden suprimir el eje hipotalámico-pituitaria-gonadal (HPG), lo que da lugar a una disminución de la espermatogénesis. Por lo tanto, es importante que los médicos reconozcan el uso previo de la TRT o los EAA en los pacientes que se presentan para el tratamiento de la infertilidad. El cese del uso de la TRT o los EAA puede dar lugar a la recuperación espontánea de la espermatogénesis normal en un número razonable de pacientes si se les da tiempo suficiente para la recuperación. Sin embargo, es posible que algunos pacientes no recuperen la espermatogénesis normal o que no toleren la espera de una recuperación espontánea. En tales casos, los médicos deben ser conscientes de las alteraciones fisiopatológicas del eje HPG relacionadas con el uso de la TRT o los EAA y los agentes farmacológicos disponibles para revertirlas. Los agentes disponibles incluyen gonadotropinas inyectables, moduladores selectivos de los receptores de estrógeno e inhibidores de la aromatasa, pero su uso no indicado está pobremente descrito en la literatura, lo que puede crear una laguna de conocimiento para el médico. Examinar su uso clínico para el tratamiento del hipogonadismo hipogonadotrópico y otras anomalías del eje HPG puede familiarizar al médico con la manera en que pueden utilizarse para recuperar la espermatogénesis después del uso de la TRT o los EAA.
Palabras clave: esteroides anabólicos (EAA), hipogonadismo, infertilidad, espermatogénesis, testosterona, terapia de reemplazo de testosterona (TRT), reversión de la vasectomía (RV)
INTRODUCCIÓN
En años recientes, el marketing masivo ha permitido una mayor conciencia pública de la disminución de los niveles de testosterona sérica relacionados con la edad y la asociación del hipogonadismo con muchas comorbilidades médicas ya conocidas. Esto ha impulsado en parte el crecimiento de la terapia de remplazo de testosterona (TRT) para el hipogonadismo, la cual experimentó un aumento de 12 veces en las ventas en todo el mundo entre el 2000 y el 2011 (estadística sin incluir las ventas de producto en el mercado negro). Esto no es sorprendente, ya que aproximadamente el 7% de los hombres menores de 40 años y el 38% de los hombres mayores de 45 años demuestran hipogonadismo bioquímico cuando se define como <300 ng dL sericos. Por lo tanto, los hombres más jóvenes están buscando tratamiento para el hipogonadismo y hasta el 12,4% de todas las prescripciones de testosterona se producen en hombres de menos de 39 años de edad.

De manera similar a la TRT, también ha habido un aumento en la disponibilidad y el uso de esteroides anabólicos androgénicos (EAA). Se estima que hasta 3 millones de personas utilizan EAA sólo en los Estados Unidos, incluido hasta el 3% de los adolescentes en edad de escuela secundaria, el 14% de los atletas universitarios y el 30% de los entrenadores de peso de la comunidad; sin embargo, muchas de estas estimaciones se basan en datos más antiguos. Un examen más reciente reveló que el uso del EAA es una causa común de hipogonadismo profundo y que hasta uno de cada cinco hombres que buscan tratamiento para el hipogonadismo ha informado de haber usado EAA con anterioridad. Además, muchos “suplementos dietéticos” utilizados para la mejora atlética o cosmética también contienen discretamente EAA, con tasas de contaminación de hasta el 15%. Lamentablemente, hasta el 50% de los usuarios anteriores de EAA deciden no revelar su uso previo de EAA a los médicos, lo que puede enmascarar la impresión general de los médicos sobre la carga que supone el abuso del EAA.
Tanto la TRT como el uso de EAA pueden conducir a la supresión del eje hipotalámico-pituitaria-gonadal (HPG), lo que resulta en una disminución de la espermatogénesis y la posible infertilidad.
La recuperación espontánea de la espermatogénesis tras el cese de la TRT o los EAA es posible, pero puede tardar de varios meses a varios años, y en algunos casos puede ser infertilidad permanente.
En conjunto, el aumento del uso de la TRT y los EAA en hombres jóvenes y de mediana edad, junto con un cambio social hacia una mayor edad paterna, está creando un entorno en el que es cada vez más probable que los médicos se encuentren con hombres que buscan tratamiento para la infertilidad relacionada con el uso previo de la TRT y/o los EAA o tratamiento para el hipogonadismo con interés en preservar su fertilidad. Mientras tanto, los hombres se presentan a los especialistas en infertilidad para la reversión de la vasectomía (RV) a una edad media de 41 años (n = 1300), algunos de los cuales también pueden sufrir de hipogonadismo e informan sobre el uso actual o anterior de la TRT.
ESPERMATOGÉNESIS NORMAL
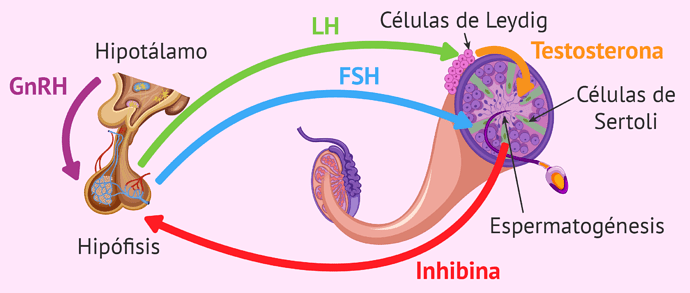
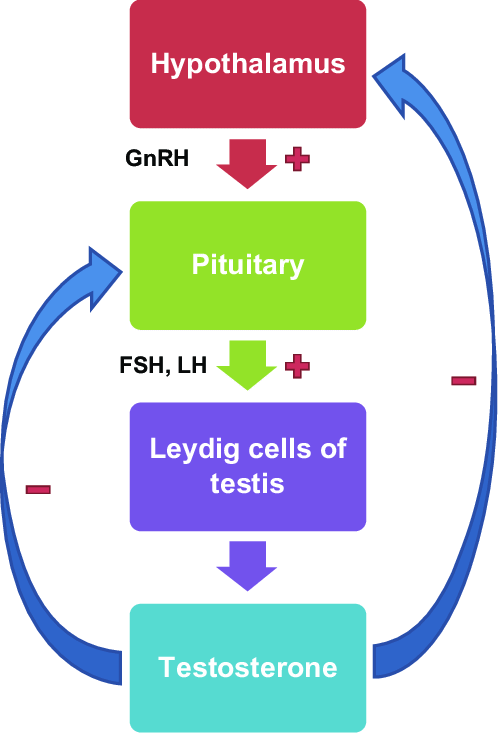
La espermatogénesis normal depende de una señalización apropiada del eje HPG. Esta señalización consiste inicialmente en una liberación pulsátil de la hormona liberadora de gonadotropina (GnRH) desde el hipotálamo a través del sistema portal hacia la glándula pituitaria, donde la estimulación da lugar a la liberación de gonadotropina. La hormona luteinizante (LH) de la hipófisis estimula a las células de Leydig en los testículos para que produzcan testosterona y conduce a la producción intratesticular del factor de crecimiento similar a la insulina 1 (IGF-1), que desempeña un papel integral en la regulación de los receptores de la LH de las células de Leydig, la esteroidogénesis y la maduración. La hormona foliculoestimulante (FSH) de la hipófisis estimula las células de Sertoli en los testículos, lo que favorece la diferenciación y la maduración de los espermatogonias. Tanto la FSH como el mantenimiento de altos niveles de testosterona intratesticular (TI o ITT en ingles) (50-100 veces más altos que el suero) en respuesta a la LH son críticos para que ocurra una espermatogénesis normal. Históricamente, se pensaba que la proteína de unión a los andrógenos producida por las células de Sertoli era responsable de esos altos niveles de testosterona intratesticular, pero datos recientes sugieren que otros factores también están involucrados. Curiosamente, los estudios en animales han demostrado que la ausencia de señalización de la FSH da lugar a una espermatogénesis deficiente, mientras que la pérdida de niveles de testosterona intratesticular suficientemente altos da lugar a la ausencia de espermatogénesis.
Fuente imagen:reproduccionasistida.org
La regulación del eje HPG se produce mediante la inhibición de la retroalimentación. La testosterona endógena inhibe directamente la liberación de GnRH y LH en el hipotálamo y la hipófisis, respectivamente, lo que conduce a la atenuación de la producción de testosterona. La testosterona también regula indirectamente la secreción de gonadotropinas por medio del estrógeno, derivado de la conversión de la testosterona en la periferia por la enzima aromatasa. El estrógeno exhibe un mayor efecto en la secreción de LH que la FSH, aunque se produce una inhibición adicional de la retroalimentación de la FSH con la inhibición B secretada por las células de Sertoli. Los niveles de inhibina B se han considerado un sustituto de la espermatogénesis; por ejemplo, los hombres con defectos espermatogénicos expresan niveles más bajos de inhibina B. Otros factores autocrinos, paracrinos y endocrinos adicionales dentro del hipotálamo, la hipófisis y los testículos pueden funcionar para modular aún más el eje HPG de formas complejas, entre ellas los endocannabinoides, la GnRH, la bespeptina, la norepinefrina, la hormona del crecimiento, las interleucinas y el TGF-β. Por lo tanto, el eje HPG representa un sistema dinámico, pero estrechamente regulado, a múltiples niveles que da lugar a la espermatogénesis, entre otras cosas.
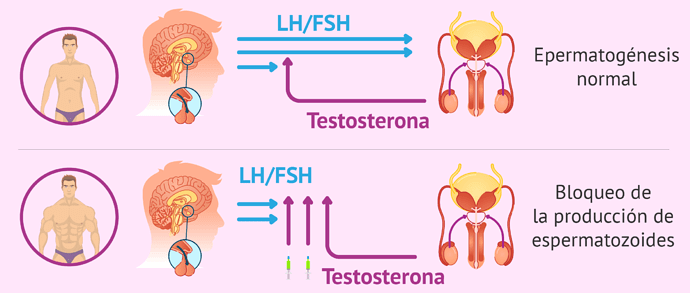
INFLUENCIA DE LOS ANDRÓGENOS EXÓGENOS EN LA ESPERMATOGÉNESIS
El uso de andrógenos exógenos puede influir en el eje HPG mediante mecanismos similares a los de la testosterona endógena al ejercer una retroalimentación negativa en función de la dosis y la duración, lo que da lugar a reducciones en la testosterona intratesticular, a la disminución de la producción de FSH y, en última instancia, a la disminución o el cese completo de la espermatogénesis. Faltan datos que describan específicamente la historia natural de la recuperación de la espermatogénesis sin asistencia después de una TRT a largo plazo, pero esa información puede extrapolarse de la bibliografía sobre anticonceptivos masculinos. Se han realizado múltiples ensayos internacionales en los que se han utilizado diversos preparados de testosterona y que demuestran una mediana de tiempo hasta la supresión de la espermatogénesis de <1 × 106 mL de espermatozoides en un plazo de 3,5 meses. Por otra parte, los mismos datos demuestran una mediana del tiempo de recuperación de 20 × 106 mL de espermatozoides que oscila entre 3 y 6 meses, con estimaciones de probabilidad que sugieren la recuperación en el 67%, 90%, 96% y 100% de los hombres a los 6, 12, 16 y 24 meses, respectivamente, después de la interrupción de la exposición a la testosterona. Estos datos también sugieren que una exposición más prolongada a la testosterona exógena, a la etnia asiática y a la edad avanzada puede dar lugar a un tiempo de recuperación prolongado después de la interrupción del tratamiento. Ciertamente, los hombres con un historial previo de varios años de uso de TRT o EAA pueden no esperar la misma tasa de recuperación.
Los esteroides anabolicos son derivados sintéticos de la testosterona con modificaciones químicas destinadas a imitar más los efectos anabólicos que los androgénicos de la testosterona. Muchos consumidores usan regímenes de “apilamiento” con múltiples esteroides anabolicos en altas dosis para maximizar la masa muscular y el aumento de peso, que a menudo se “ciclan” para minimizar los efectos secundarios. No obstante, los EAA todavía pueden unirse al receptor androgénico dentro de las células diana y ejercer los mismos efectos de retroalimentación negativa que la testosterona endógena, lo que a menudo da lugar a un hipogonadismo inducido por esteroides anabólicos (anabolic steroid-induced hypogonadism o ASIH por sus siglas en inglés) y a reducciones asociadas con los niveles de gonadotropina sérica y de testosterona intratesticular. Con una testosterona intratesticular y una FSH anormalmente bajas, estos pacientes suelen presentar azoospermia u oligospermia con movilidad y/o morfología reducidas en el análisis de semen.
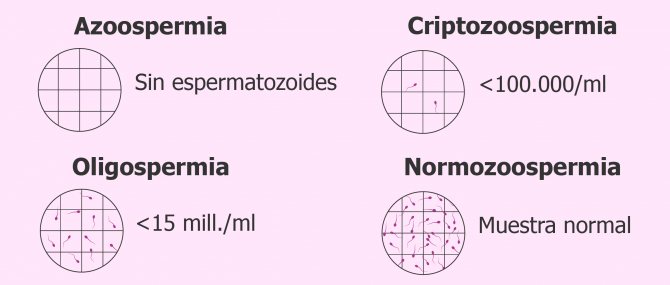
Fuente de la imagen:www.reproduccionasistida.org
Esos efectos en el eje de HPG son potencialmente reversibles con el cese del uso de EAA, pero el tiempo de recuperación es muy variable y está influido por la dosis y el grado de apilamiento de múltiples esteroides anabolicos, la duración del uso de esteroides anabolicos y la edad del paciente. Los datos que se refieren específicamente a la recuperación de la espermatogénesis tras el cese de los EAA son escasos, pero los informes de casos indican que la recuperación es factible en un plazo de 4 a 12 meses, aunque algunos pacientes pueden necesitar hasta 24 a 30 meses para volver a concentraciones de espermatozoides de >20 × 106 mL. No puede subestimarse que, dada la variabilidad inherente de las características de los pacientes y del o los EAA utilizados, no puede esperarse una recuperación uniforme del eje HPG en todos los pacientes.
AGENTES FARMACOLÓGICOS PARA RESTAURAR O MANTENER LA ESPERMATOGÉNESIS
Gonadotropinas: HCG y FSH
La gonadotropina coriónica humana (HCG) es una proteína natural producida por la placenta humana con una vida media en suero de aproximadamente 36 h. Estructuralmente, la HCG comparte una subunidad α idéntica con la LH y la FSH. Sin embargo, la HCG tiene una subunidad β única que es virtualmente idéntica a la subunidad β de la LH, excepto que tiene una cola adicional de 24 aminoácidos en la terminal de aminoácidos de la proteína, la cual es altamente glicosilada y conduce tanto a una vida media circulante más larga de la HCG (~36 h) versus la LH (~30 min) como a una mayor actividad de los receptores. El aumento de la actividad del receptor de la LH, junto con su mayor vida media, la convierte en un análogo de la LH clínicamente útil. La HCG, que se extrae inicialmente de la orina de mujeres embarazadas, ha demostrado ser eficaz para restablecer la espermatogénesis. Ha surgido una nueva HCG recombinante (Ovitrelle) que se considera equivalente a las fuentes urinarias desde el punto de vista farmacológico.
De forma similar, la FSH se ha derivado tradicionalmente de la orina de mujeres posmenopáusicas en forma de gonadotropina menopáusica humana (HMG por sus siglas en inglés). Una gran proporción de la HMG que se produce naturalmente consiste en proteínas urinarias copurificadas inactivas en el receptor de la FSH, y una proporción menor contiene una mezcla de FSH, LH y HCG.
Por consiguiente, de manera similar a la HCG, los refinamientos han llevado a la producción de HMG urinaria altamente purificada, y más recientemente de FSH recombinada (FSHr), para lograr una mayor especificidad para el receptor de la FSH. Hasta la fecha, no se han realizado comparaciones directas entre ambas para su uso en la inducción de la espermatogénesis en los hombres, pero los datos sobre su uso en las mujeres sugieren que la FSHr es equivalente a los preparados urinarios y puede evitar el riesgo teórico de la enfermedad de Creutzfeld-Jakob ; por lo tanto, la FSHr es el método preferido de administración farmacológica de la FSH en los hombres.
Nombres comerciales de FSH recombinante: Foligraf, Puregon
Desde el punto de vista clínico, la HCG ha demostrado ser eficaz para inducir y/o mantener la espermatogénesis sola o en combinación con la FSH en pacientes con hipogonadismo hipogonadotrópico (HH). El HH es una causa poco común pero tratable de la infertilidad por factor masculino, considerada clásicamente secundaria a la patología del hipotálamo o la glándula pituitaria, como se observa en el síndrome de Kallman, el síndrome de Prader-Willi, el panhipopituitarismo por prolactinomas, tumores, infección o radiación, o causas idiopáticas. Por lo tanto, los hombres con azoospermia o defectos espermatogénicos graves debidos al HH clásico sirven como un contexto útil en el que apreciar clínicamente el efecto de las gonadotropinas sobre la espermatogénesis. Sin embargo, debido a la poco común prevalencia del HH, se carece de datos de alta calidad y la mayoría se limita a informes de casos y series retrospectivas.
Históricamente, los enfoques de tratamiento para la HH se han centrado en la terapia fisiológica de la GnRH pulsátil para inducir características sexuales secundarias y la espermatogénesis, con tasas de embarazo notificadas de hasta el 80%. Sin embargo, el uso generalizado de la GnRH pulsátil es intrínsecamente limitado debido a la necesidad de una bomba externa para la liberación periódica de hormonas, el costo y la necesidad de una glándula pituitaria funcionalmente intacta para responder adecuadamente a las señales hipotalámicas. Alternativamente, el tratamiento con regímenes de gonadotropinas inyectables ha demostrado una eficacia clínica equivalente en comparación con la GnRH para desencadenar la espermatogénesis sobre la base de un metaanálisis reciente. Por lo tanto, las gonadotropinas ofrecen a los pacientes un enfoque de tratamiento eficaz y más conveniente. La FSH administrada sola o en combinación con testosterona ha demostrado no tener éxito en la inducción de la espermatogénesis o el mantenimiento de la espermatogénesis en aquellos pacientes a los que se les había inducido previamente con HCG/ FSH ( HCG 1500 UI y HMG 150 UI tanto subcutánea como 3 veces por semana), confirmando la necesidad de mantener un nivel elevado de testosterona intratesticular. Sin embargo, el uso a largo plazo de la HCG por sí sola puede inducir la espermatogénesis hasta en un 70% de los pacientes, con un mayor efecto observado en los hombres con una longitud inicial del testículo de >4 cm, pero se aprecia una mayor mejoría con la adición de FSH (HMG) que sugiere una recuperación más oportuna con ambas gonadotropinas. El éxito de la inducción de la espermatogénesis con una combinación de HCG y FSH está respaldado por varios estudios (Tabla 1). En estos datos, la mayoría comienza estimulando la producción de testosterona endógena con un ensayo de HCG sola con dosis que oscilan entre 1500 y 5000 UI 2-3 veces por semana ajustadas según los niveles de testosterona sérica.
| Estudio | Dosis HCG (unidades internacionales) | vec. / semana | Dosis FSH (unidades internacionales) | vec. / semana | Pacientes | Duracion (meses) | Espermatogenesis (recuperacion %) | Tasa Embarazo (%) |
|---|---|---|---|---|---|---|---|---|
| Burger Baker | 1500-3000 | 1-2 | 200-400 | 3 | 45 | 6-28 | - | 50 |
| Buchter et al. | 1000-2500 | 2 | 75-150 | 3 | 39 | 3-46 | 95 | 72 |
| EM HP Study Group | 2000 | 2 | 150 | 3 | 26 | 18 | 100 | - |
| Burgeus & Calderon | 2500 | 2 | 150 | 3 | 60 | 6-9 | 80 | - |
| Bouloux et al. | 1500-3000 | 2 | 150-225 | 3 | 30 | 11 | 44 | - |
| Miyagawa et al. | 3000 | 2 | 75-150 | 2 | 36 | 12-48 | 50 | - |
| Ishikawa et al. | 5000 | 3 | 150 | 3 | 28 | 6-144 | 64 | - |
| Liu et al. | 1500-2000 | 2-3 | 75-150 | 3 | 75 | 6-35 | 90 | - |
| Farhat et al. | 1500-5000 | 3 | 75-150 | 3 | 87 | 6-49 | - | 56 |
| Tabla 1. |
La mayoría de los expertos utilizan la HCG sola durante 3 a 6 meses, después de lo cual un cierto número de casos dará lugar a la inducción de la espermatogénesis. En aquellos sin una adecuada inducción de espermatogénesis, el tratamiento procede con la adición de FSH con dosis que van desde 75 a 400 UI 2-3 veces por semana tituladas según los resultados de los análisis de semen. Se informó de que el éxito definido como la inducción de la espermatogénesis con espermatozoides de >1-1,5 × 106 mL se produjo en el 44%-100% de los pacientes tratados durante 6-144 meses. Cuando se informó de ello, se observaron tasas de embarazo en el 40%-75% de los pacientes, por lo general a niveles de concentración de espermatozoides inferiores a los “normales”. Entre los factores que predicen el éxito figuran un mayor volumen testicular de referencia, la exposición previa a gonadotropinas naturales (pubertad normal) y ciclos de tratamiento repetidos, mientras que la exposición previa a testosterona exógena y el criptorquidismo presagian una respuesta más lenta, aunque estos resultados son variables. Es importante considerar que estos datos se encuentran en hombres con HH por causas clásicas y no en pacientes con uso previo de TRT/EAA en los que teóricamente se pueden esperar mejores resultados dada la probabilidad de un desarrollo normal de la pubertad y la función del eje HPG en algún momento antes de la exposición a la/los TRT/EAA.
Son escasos los datos que evalúan específicamente la inducción o el mantenimiento de la espermatogénesis en los hombres con HH y azoospermia específicamente debido al uso previo de TRT y/o EAA (Tabla 2). En un estudio de hombres normales tratados con TRT y asignados al azar a la administración simultánea de placebo o de una dosis baja de HCG (125, 150 o 500 UI) cada dos días, se mantuvieron los niveles de TI en todos los grupos de HCG con los niveles más cercanos a su valor inicial normal en los grupos de dosis de 250 y 500 UI, lo que sugiere la preservación de la espermatogénesis. Estos datos están respaldados por el hallazgo de Depenbusch y sus colegas de que la preservación de la espermatogénesis es posible con la HCG sola (500-2500 UI dos veces por semana, según los niveles de testosterona en suero) en los hombres con HH y azoospermia en los que la espermatogénesis se inició previamente con HCG/FSH. Sin embargo, en este estudio, la espermatogénesis sólo se mantuvo “cualitativamente”, en el sentido de que las concentraciones medias de espermatozoides con HCG sola fueron del 43% de los niveles alcanzados anteriormente con la inducción de la espermatogénesis mediante una combinación de HCG y FSH, lo que sugiere que ambas son necesarias para una espermatogénesis normal “cuantitativamente”.
| Medicamento | Dosis de mantenimiento | Dosis de restauración | Terapia combinada | Consideraciones de dosis |
|---|---|---|---|---|
| Análogos de la gonadotropina | ||||
| GCH | 500-2500 UI 2x /semana 500 UI día de por medio | 3000 UI día de por medio 10000 UI 3x/semana 1000-3000 UI 3x/semana | Si, con FSH SERM AI | Ajustar dosis según respuesta de los niveles de testosterona |
| FSH recombinante | 75 UI diariamente 150 UI 3x/semana 75-100 UI 3x/semana | Si, con GCH | Típicamente iniciar con o agregar a régimen con GCH y ajustar dosis cada 3 meses en respuesta al análisis de semen | |
| SERM | 25 mg diariamente o 50 mg día de por medio Nota, no existen datos que respalden esta indicación | 50 mg 3x/semana 25-50mg día de por medio 100 mg diariamente 25mg diariamente | Si, con GCH | Ajustar dosis en base a la respuesta de los niveles de testosterona Monitorear parámetros de semen |
| Enclomifeno | 12.5-25mg diariamente | 25mg diariamente | Datos de Fase III y aprobación de la FDA esa pendiente | |
| AI | ||||
| Anastrozol | 1 mg diariamente | Si, con GCH | Útil como una terapia adyuvante en los escenarios que T: E<10:1 | |
| Letrozol | 2.5 mg diariamente | Precaución de posible hepatotoxicidad y riesgo de embolismo pulmonar | ||
| Tabla 2. | ||||
| 2x: 2 veces; 3x: 3 veces; mg: miligramo; UI: unidades internacionales; GCH: gonadotropina coriónica humana; FSH: hormona foliculoestimulante; SERM: moduladores selectivos de los receptores de estrógenos; AI: Inhibidores de la aromatasa; FDA: administración de drogas y alimentos |
Importante: Por otra parte, una serie de hombres hipogonadales que deseaban preservar la fertilidad mientras iniciaban la TRT con diferentes agentes (geles e inyecciones transdérmicas) demostraron que la HCG en dosis bajas (500 UI cada dos días) preserva todos los aspectos de los parámetros del semen analizados a pesar de la mejora en los niveles de testosterona sérica, y sin que se observaran diferencias entre los diferentes tipos de agentes de TRT utilizados.
Una serie interinstitucional más reciente de hombres tratados previamente con TRT y de los que se estableció que eran azoospérmicos o gravemente oligospérmicos (<1 × 106 mL) recibieron HCG 3000 UI en días alternos complementados con FSH, citrato de clomifeno (CC), tamoxifeno. Esta serie demostró una recuperación media de la espermatogénesis hasta una densidad de 22 × 106 mL en 4 meses. De manera similar, una serie de hombres hipogonadales en TRT que buscaban la reversión de la vasectomía (RV) se sometieron a una “recuperación testicular” con CC y HCG (3000 UI en días alternos) antes de la reversión de la vasectomía (RV), lo que dio lugar a la normalización de los parámetros del eje HPG y a una reversión de la vasectomía (RV) satisfactoria en el 83%. Por último, se dispone de aún menos datos para apoyar el uso de gonadotropinas para la restauración de la espermatogénesis en hombres azoospérmicos con hipogonadismo inducido por esteroides anabólicos después del uso de EAA. Unos pocos informes de casos indican que la HCG sola en dosis variables (2000 UI 3 veces por semana a 10 000 UI una vez por semana) o ambas, la HCG (10 000 UI semanales) y la FSH (75 UI diarias) en combinación pueden restablecer la espermatogénesis y en algunos casos conducir a la concepción. En conjunto, estos datos demuestran que la restauración y el mantenimiento de la espermatogénesis mediante el uso de gonadotropinas es una estrategia exitosa en los hombres con uso previo de TRT y/o EAA, con resultados similares a los observados con el uso de gonadotropinas en los hombres con HH clásico.
Si buscas mas informacion sobre el hipogonadismo primario (HH) y secundario (Hh), aqui tienes otro articulo interesante:
Moduladores selectivos de receptores de estrógeno (SERM)
Los SERM son un grupo de medicamentos que funcionan interrumpiendo la unión del estrógeno a los receptores de estrógeno en el hipotálamo a través de un antagonismo competitivo. En los hombres, la unión normal del estrógeno a estos receptores funciona como un mecanismo de retroalimentación negativa indirecta de la producción endógena de testosterona para reducir la producción de GnRH y, por consiguiente, la producción de gonadotropina en la pituitaria. Por lo tanto, los SERM funcionan para bloquear la retroalimentación de estrógeno y así aumentar la producción de GnRH y gonadotropinas y, en última instancia, aumentar los niveles de testosterona intratesticular en los hombres sin evidencia de hipogonadismo primario. Clínicamente, el tamoxifeno y el citrato de clomifeno son dos de los SERM más comúnmente utilizados, siendo el primero popularizado por su uso en los protocolos de tratamiento del cáncer de mama y el segundo popularizado por su desarrollo inicial para desencadenar la ovulación en las mujeres. El citrato de clomifeno existe como una mezcla racémica de enclomifeno de acción más corta (efectos puramente antiestrogénicos) y de zuclomifeno de acción más larga (efectos tanto agonistas como antagonistas del estrógeno) y presenta una vida media en suero de aproximadamente 5 días.
El uso del citrato de clomifeno en hombres se informó por primera vez en 1966 para el tratamiento de hombres subfértiles con el fin de mejorar las tasas de embarazo sobre la base del beneficio teórico de su mecanismo de acción. Desde entonces, se ha utilizado en forma extraoficial para tratar varias subpoblaciones de hombres infértiles con programas de dosificación que oscilan entre 25 y 50 mg administrados diariamente, día de por medio o cíclicamente con “períodos de descanso” intermitentes, todos los cuales pueden ser ajustados sobre la base de los niveles de testosterona sérica. Varios estudios que analizan el uso del citrato de clomifeno (CC) en hombres con hipogonadismo secundario demuestran una clara mejora en los niveles de testosterona sérica, los síntomas hipogonadales y la testosterona: las proporciones de estrógeno indican los efectos terapéuticos positivos del CC en el eje HPG. De manera análoga, el uso de la CC en hombres con oligospermia idiopática o azoospermia con o sin hipogonadismo ha demostrado cambios favorables en los perfiles hormonales y los análisis de semen, pero los datos que evalúan las tasas de embarazo han arrojado resultados contradictorios. En general, el CC se tolera bien y se considera seguro en los hombres, que tienden a experimentar muchos menos efectos secundarios que los observados con el uso del CC en las mujeres. Sin embargo, los informes de casos aislados han demostrado la posibilidad de desarrollar azoospermia con el uso del CC en hombres oligospérmicos que es reversible con el cese del CC. Por esta razón, es necesario informar a los pacientes de los potencialmente impredecibles resultados, y que los estudios laboratoriales de suero y los análisis de semen de seguimiento son importantes durante el tratamiento con CC.
La literatura que evalúa el uso de CC para restaurar la espermatogénesis en hombres oligospérmicos y azoospérmicos con HH después del uso de TRT y/o EAA es muy limitada (Tabla 2). Los informes de casos de uso de clomifeno en dosis más altas (100 mg diarios) en hombres jóvenes con hipogonadismo inducido por esteroides anabólicos dieron lugar a la normalización del eje HPG en un plazo de 2 a 3 meses, pero no se evaluó la espermatogénesis. Una pequeña y retrospectiva serie de casos que observaba a dos hombres con HH idiopático, adquirido con oligospermia y azoospermia, y un hombre con hipogonadismo inducido por esteroides anabólicos y azoospermia a los que se les dio a cada uno CC 50 mg 3 veces por semana, encontró un 100% de recuperación de gonadotropinas séricas, testosterona y espermatogénesis en 3 meses y un 66% de tasa de embarazo. Más recientemente, una serie retrospectiva más amplia de 63 hombres a los que se les administró una combinación de HCG 3000 UI 3 veces por semana y CC o tamoxifeno demostraron una recuperación de la espermatogénesis de >1 × 106 mL de espermatozoides en el 98% de los hombres en 4-5 meses, con una concentración inicial media de espermatozoides de 22.6 × 106 mL. De manera similar, un régimen de rescate testicular de CC 25 mg diarios o la combinación con HCG 3000 UI en días alternos para seis hombres con antecedentes de TRT que se presentaron para recibir RV, resulto en la normalización del eje HPG y en una RV exitosa en el 83% de los pacientes.
El citrato de clomifeno consiste en una mezcla racémica de zuclomifeno y enclomifeno, y este último presenta efectos puramente antiestrogénicos con una vida media relativamente más corta (10,5 h) que el CC. Por lo tanto, los resultados recientemente comunicados sobre el uso de citrato de enclomifeno en los hombres son más prometedores que el citrato de clomifeno (CC). Se han realizado varios ensayos clínicos favorables, pero todavía está pendiente la aprobación oficial de la FDA. Un ensayo clínico de fase IIB hizo el seguimiento de 12 hombres tratados previamente con TRT durante más de 6 meses y diagnosticados con HH con oligospermia o azoospermia, se les asignó al azar 25 mg diarios de enclomifeno en comparación con un gel de testosterona tópico durante 6 meses. El estudio demostró respuestas equivalentes en los niveles de testosterona sérica en ambos grupos, y se apreciaron mejoras estadísticamente significativas en los parámetros del semen en el grupo con enclomifeno (P = 0,004). De manera similar, otro ensayo de fase II que analizó el uso de enclomifeno en hombres con hipogonadismo secundario demostró aumentos en los niveles de testosterona y gonadotropina sérica dentro de las 2 semanas de tratamiento. Finalmente, el ensayo de fase IIB más reciente estudió 73 hombres con hipogonadismo y espermatogénesis normal a los que se les asignó al azar enclomifeno 12,5 mg o 25 mg diarios, TRT tópica o placebo. Se demostraron aumentos equivalentes en los niveles de testosterona, estradiol y LH séricos entre los grupos de TRT y enclomifeno, pero se observó un aumento en la oligospermia y la azoospermia en el grupo de TRT, mientras que la espermatogénesis se preservó en los grupos de enclomifeno y placebo. Por lo tanto, la enclomifeno representa un nuevo y emocionante tratamiento en el horizonte para la restauración y preservación de la espermatogénesis en hombres hipogonadales, que posiblemente obtenga la futura aprobación de la FDA en espera de los resultados de los próximos estudios de fase III.
Inhibidores de la aromatasa (IA)
Los inhibidores de la aromatasa son una clase de medicamentos aprobados por la FDA para el tratamiento del cáncer de mama en etapas tempranas y tardías e históricamente incluyen esteroides no selectivos y agentes no esteroideos altamente selectivos, incluyendo el anastrozol y el letrozol. Los IA funcionan inhibiendo la enzima aromatasa, que es un convertidor del citocromo P450 de testosterona a estrógeno dentro de los testículos, el hígado, el cerebro y los tejidos adiposos. El estrógeno es un mediador indirecto de la retroalimentación inhibitoria de testosterona del eje HPG. Por lo tanto, la inhibición de la aromatasa en los hombres puede dar lugar a una disminución de los niveles de estrógeno y, en última instancia, a un aumento de la producción de gonadotropinas. Su uso clínico en los hombres está fuera de lo indicado y se ha centrado en mejorar la infertilidad masculina y los síntomas de hipogonadismo, en particular en los hombres obesos o en los que tienen una relación testosterona/estrógeno (T/E) sérica <10, donde se han observado mejoras de aproximadamente el 77%. Además, se pueden prescribir IA para su uso con testosterona exógena o HCG con el fin de mitigar los efectos secundarios de la hiperestrogenemia, como la ginecomastia.
Los estudios que evalúan el uso de IA más antiguos en hombres oligospérmicos han sugerido mejoras en las relaciones T/E y la espermatogénesis, pero los datos aleatorios controlados que utilizan la testolactona no respaldan estos hallazgos. Sin embargo, datos recientes de Raman y Schlegel compararon la testolactona Teslac (500-1000 mg dos veces al día) con un IA más selectivo, el anastrozol (1 mg diario), en hombres subfértiles. Los pacientes tenían proporciones anormales de T/E junto con oligospermia o azoospermia idiopática, y el estudio demostró una mejora estadísticamente significativa de las proporciones de T/E y los parámetros espermatogénicos con anastrozol en aquellos con oligospermia, pero no en aquellos con azoospermia. Un éxito similar al añadir anastrozol (1 mg diario) al tratamiento existente en hombres con oligospermia idiopática y proporciones T/E anormalmente bajas que no responden a 3 meses de tratamiento con tamoxifeno solo, demuestra una mejora en la concentración y la motilidad de los espermatozoides. La anterior sugerencia de que los IA no mejora los parámetros del semen en los hombres con azoospermia no obstructiva por parte de Raman y Schlegel ha sido cuestionada por los datos recientes que muestran mejores tasas de éxito con la extracción microquirúrgica de espermatozoides testiculares en los hombres con síndrome de Klinefelter no metastático y niveles normalizados de testosterona sérica después del tratamiento con anastrozol preoperatorio. El uso del letrozol (2,5 mg diarios), un nuevo y más selectivo IA, ha demostrado mejoras en la relación T/E y en los parámetros espermatogénicos similares a los del anastrozol, con una tasa de embarazo espontáneo de hasta el 20% en los hombres oligospérmicos y un retorno del 24% de los espermatozoides al eyaculado de los hombres previamente azoospérmicos.
En los ensayos prospectivos no se ha informado del uso de IA en hombres infértiles con uso previo de TRT y/o EAA. La serie retrospectiva antes mencionada de Wenker y otros, en la que se evaluó la HCG utilizada simultáneamente con los SERM, los IA y la FSH, en hombres con uso previo de TRT y oligospermia o azoospermia grave, demostró una tasa general de éxito del 98% en la recuperación de la espermatogénesis y una tasa de embarazo espontáneo del 38%, sin diferencias entre el tipo de terapia suplementaria administrada con la HCG o el tipo de TRT utilizado (Tabla 2). Más recientemente, se realizó un estudio de 26 hombres con hipogonadismo, estériles y no azoospérmicos asignados al azar a CC 25 mg diarios o a anastrozol 1 mg diario durante 6 semanas, que demostró mejoras tanto en los niveles generales de testosterona como en la relación T/E, pero el citrato de clomifeno tuvo un mayor impacto en los niveles de testosterona y el anastrozol tuvo un mayor impacto en la relación T/E. Por lo tanto, en los hombres hipogonadales con relaciones T/E <10, se pueden utilizar citrato de clomifeno e IA simultáneamente para lograr el mejor resultado; sin embargo, esta combinación farmacológica teóricamente beneficiosa no se ha documentado en estudios prospectivos, pero anecdóticamente puede resultar útil.
En general, el uso de los IA es bien tolerado en las mujeres, pero se han notificado niveles elevados de enzimas hepáticas en hasta el 17% de los pacientes, lo que sugiere precaución en los que tienen antecedentes de disfunción hepática. Una serie en la que se evaluó el anastrozol para el tratamiento del hipogonadismo secundario en 69 hombres mayores, seguida durante un año, confirmó una tasa generalmente baja de acontecimientos adversos, aunque se informó de un caso de cada uno de los nuevos diagnósticos de hepatitis, embolia pulmonar y accidente cerebrovascular embólico. Además, algunos datos han sugerido un potencial empeoramiento de la salud osteoesquelética con el uso de anastrozol en hombres mayores, presumiblemente basado en niveles más bajos de estrógeno. En conjunto, los IA pueden tener una influencia positiva en el eje HPG después del uso de la TRT o los EAA, pero en ausencia de datos clínicos más sólidos y un perfil incierto de efectos secundarios con el uso a largo plazo, el uso de los IA puede limitarse a un papel complementario sólo en aquellos que tienen proporciones T/E anormalmente bajas.
ESCENARIOS CLÍNICOS
Los hombres con infertilidad relacionada con el uso previo de la TRT y/o EAA pueden presentar una serie de escenarios clínicos que resultan un reto para manejar como médico. En esta revisión, hemos proporcionado la fisiopatología de los efectos de la TRT y los EAA sobre la espermatogénesis normal y las herramientas farmacológicas disponibles para potencialmente revertir estos efectos. Es común encontrar ciertos escenarios clínicos, y a continuación se presenta una breve discusión de las recomendaciones de estos autores para el tratamiento en cada escenario.
1. Hombre infértil con una historia reciente o uso actual de TRT y/o EAA
Un paciente que se presenta para el tratamiento de la infertilidad por factor masculino, indicado por oligospermia o azoospermia no obstructiva, que reporta una historia reciente o el uso actual de TRT y/o EAA es un escenario común al que se enfrenta un especialista en fertilidad masculina. Se podrían discutir varias opciones dependiendo de la gravedad de sus síntomas hipogonadales, el momento en que él y su pareja deseen lograr el embarazo, y suponiendo que no haya pruebas clínicas de hipogonadismo primario.
Si el paciente y su pareja están dispuestos a esperar y sus síntomas hipogonadales son manejables sin TRT o EAA, el paciente podría simplemente descontinuar el uso de TRT o EAA para permitir una recuperación espontánea. Los datos de la literatura sobre anticoncepción masculina indican una probabilidad razonable de recuperación en el 67%, 90%, 96% y 100% de los hombres a los 6, 12, 16 y 24 meses, respectivamente, con una mediana de tiempo de recuperación de 20 × 106 mL de espermatozoides en 3-6 meses. Sin embargo, muchos hombres no tolerarán la interrupción debido a síntomas hipogonadales graves, a la incertidumbre de la recuperación y/o a problemas con el tiempo, y estos hombres pueden requerir alguna forma de suplemento androgénico alternativo. Por lo tanto, se podrían administrar análogos de gonadotropina similares a los que se implementan en pacientes con HH. Asumiendo que no hay un componente fundamental de hipogonadismo primario, esta opción es segura, trataría los síntomas hipogonadales y aceleraría el tiempo de recuperación. Es razonable comenzar con la inyección subcutánea de HCG 3000 UI 3 veces por semana durante 3 meses con un ajuste adicional en espera de los niveles provisionales de testosterona sérica, aunque la dosis óptima de HCG no se ha establecido claramente. Si a los 3 meses los parámetros seminales no han mejorado, se podría añadir FSH. Una dosis inicial típica es la de rFSH 75 UI de inyección subcutánea 3 veces a la semana.
Durante la terapia con gonadotropinas, se suelen aplicar tratamientos complementarios con IA o SERM. Tal enfoque ha demostrado en promedio excelentes resultados en un plazo de 4 a 5 meses. CC 25 mg diarios o 50 mg en días alternos, ajustados hasta 50 mg diarios, pueden demostrar una mejora en los parámetros seminales en tan sólo 3 meses para los hombres con HH. CC es rentable y ha sido más eficaz como terapia combinada en este entorno, con datos menos extensos que la respaldan como monoterapia. Si el paciente muestra una baja relación T/E, se podría prescribir un IA, con anastrozol 1 mg oral dos veces a la semana es una dosis inicial razonable que puede ser ajustada hacia arriba o hacia abajo según la respuesta.
2. Mantenimiento de la espermatogénesis antes de comenzar o durante el uso de la TRT o el EAA
Un segundo escenario es un paciente que desea preservar la espermatogénesis existente antes de comenzar el uso de la TRT o los EAA. El mantenimiento de los niveles normales de TI es críticamente necesario para mantener la espermatogénesis. La HCG ha demostrado mantener los niveles de TI con dosis tan bajas como 500 UI en días alternos.56,57 Los datos clínicos que evalúan dosis más altas de HCG administradas como monoterapia (500-2500 UI dos veces por semana), o dosis bajas de HCG (500 UI en días alternos) en combinación con TRT, han demostrado resultados satisfactorios para mantener la espermatogénesis,57,58 y cualquiera de las dos sería una buena opción según lo recomendado por estos autores.
Por otra parte, la CC se utiliza comúnmente como alternativa a la TRT para tratar el hipogonadismo en los hombres que desean preservar la espermatogénesis. La capacidad de tomar una medicina oral que es relativamente barata y que tiene buenos datos de seguridad a largo plazo y es clínicamente eficaz para mejorar los síntomas hipogonadales es claramente ventajosa.69,71 Sin embargo, en la actualidad no se dispone de datos que evalúen específicamente el CC de esta manera, y se necesitan ensayos controlados aleatorios. El más reciente SERM en el horizonte, el CE, ha sido estudiado en el marco de la fase II de un ensayo clínico que demuestra específicamente la preservación de la espermatogénesis en el análisis de semen mientras mejora satisfactoriamente los síntomas hipogonadales y los niveles de testosterona sérica, y los datos de la fase III están pendientes.82,84 Finalmente, los IA como el anastrozol o el letrozol pueden ser útiles en este escenario clínico para los pacientes que son obesos y/o exhiben una baja relación T/E <10:1.
3. Paciente que se presenta a la reversión de la vasectomía con un historial de hipogonadismo secundario o previamente tratado con TRT
Un escenario final es un paciente que se presenta a la RV para la que, por lo demás, es un buen candidato, que tiene un historial de hipogonadismo actualmente o previamente tratado con TRT. Tal escenario es difícil porque el estado actual de su espermatogénesis puede ser deducido sólo por una historia cuidadosa, el volumen de los testículos en el examen clínico, y la prueba hormonal en suero del eje HPG. La espermatogénesis no puede ser evaluada definitivamente sin una biopsia de testículo en el marco de un paciente vasectomizado. Asimismo, el riesgo de proceder a la RV bajo la suposición de una espermatogénesis normal basada en el examen físico plantea un mayor riesgo de dificultad intraoperatoria para evaluar el líquido vascular en busca de espermatozoides y, en última instancia, un mayor riesgo de fracaso. Los datos sobre este tema son limitados, pero recientemente se publicó una pequeña serie retrospectiva de seis hombres con una edad media de 39 años que utilizaron un régimen preoperatorio de salvamento testicular de 25 mg de CC diariamente con o sin HCG 3000 UI en días alternos durante 3 meses después de la interrupción de la TRT. Después de la terapia de salvamento testicular, los autores demostraron una tasa de éxito general del 83% con la RV, que era del 100% si se realizaba al menos una vasovasostomía.60 En esa serie de casos, si se apreciaba una mejora en el volumen testicular en el examen físico y un aumento en los niveles de gonadotropina, se realizaba la RV; sin embargo, se realizó una aspiración de espermatozoides testiculares en dos de los seis hombres para confirmar la espermatogénesis antes de la RV debido a la insuficiente mejora del volumen testicular y/o la falta de mejora del eje HPG en la prueba de hormonas séricas. Por lo demás, no se ha descrito anteriormente un enfoque de ese tipo para el paciente vasectomizado antes de la RV, ni tampoco el uso de la HCG y el CC fuera de otro estudio retrospectivo,59 pero los resultados parecen prometedores. Estos autores considerarían el tratamiento con CC 25 mg diarios con HCG 3000 UI en días alternos durante 3 meses, con una reevaluación del eje HPG y un examen físico para asegurar la mejoría antes de la RV.
CONCLUSIONES
En la era del aumento del uso de la testosterona y de una mayor información sobre el uso de EAA en hombres jóvenes, los médicos deben ser conscientes de los efectos perjudiciales de estos agentes en la espermatogénesis. A medida que aumentan las pruebas en apoyo de las terapias de restauración para la recuperación de la espermatogénesis en esta población de pacientes, es importante conocer las diversas opciones de tratamiento, sus efectos en el eje HPG y cuándo utilizarlas. Una perspectiva histórica sobre el uso de gonadotropinas para el HH es útil para interpretar el uso actual de las gonadotropinas para la restauración o el mantenimiento de la espermatogénesis. Asimismo, la comprensión del uso clínico y la eficacia del CC y otros SERM ayuda a sentar las bases para la implementación de agentes más nuevos como el CE. A pesar del uso no oficial de cada uno de los agentes restauradores que se examinan en el presente documento, la falta definitiva de datos de alta calidad y la comprensión general de la endocrinología reproductiva masculina todavía en su infancia, el campo de la infertilidad masculina está avanzando rápidamente en esta área a medida que se va comprendiendo plenamente la importancia de restaurar y mantener la espermatogénesis en los hombres antes, durante y después de la TRT.
RV - reversión de la vasectomía
HCG - gonadotropina coriónica humana
HH - hipogonadismo hipergonadotrópico conocido también como hipogonadismo primario
Hh - hipogonadismo hipogonadotrópico conocido también como hipogonadismo secundario
LH - hormona leutizante
FSH - hormona foliculoestimulante
CC - citrato de clomifeno
IA - inhibidores de la aromatasa
Otras articulos relacionados con el tema de la infertilidad y uso de esteroides anabolicos (ciclos, blast & cruise o TRT)
Gracias a https://www.reproduccionasistida.org por las imagenes gracias.
Asian J Androl. 2016 May-Jun; 18(3): 373–380.
Published online 2016 Feb 23. doi: 10.4103/1008-682X.173938
PMCID: PMC4854084
PMID: 26908067
Referencias y Bibliografia
Recovery of spermatogenesis following testosterone replacement therapy or anabolic-androgenic steroid use
J Abram McBride and Robert M Coward
-
Mulligan T, Frick MF, Zuraw QC, Stemhagen A, McWhirter C. Prevalence of hypogonadism in males aged at least 45 years: the HIM study. Int J Clin Pract. 2006;60:762–9. [PMC free article] [PubMed] [Google Scholar]
-
Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitudinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endocrinol Metab. 2001;86:724–31. [PubMed] [Google Scholar]
-
Handelsman DJ. Global trends in testosterone prescribing, 2000-2011: expanding the spectrum of prescription drug misuse. Med J Aust. 2013;199:548–51. [PubMed] [Google Scholar]
-
Baillargeon J, Urban RJ, Ottenbacher KJ, Pierson KS, Goodwin JS. Trends in androgen prescribing in the United States, 2001 to 2011. JAMA Intern Med. 2013;173:1465–6. [PMC free article] [PubMed] [Google Scholar]
-
Rohrmann S, Platz EA, Selvin E, Shiels MS, Joshu CE, et al. The prevalence of low sex steroid hormone concentrations in men in the Third National Health and Nutrition Examination Survey (NHANES III) Clin Endocrinol. 2011;75:232–9. [PMC free article] [PubMed] [Google Scholar]
-
Layton JB, Li D, Meier CR, Sharpless JL, Sturmer T, et al. Testosterone lab testing and initiation in the United Kingdom and the United States, 2000 to 2011. J Clin Endocrinol Metab. 2014;99:835–42.[PMC free article] [PubMed] [Google Scholar]
-
Sjoqvist F, Garle M, Rane A. Use of doping agents, particularly anabolic steroids, in sports and society. Lancet. 2008;371:1872–82. [PubMed] [Google Scholar]
-
Evans NA. Current concepts in anabolic-androgenic steroids. Am J Sports Med. 2004;32:534–42.[PubMed] [Google Scholar]
-
Coward RM, Rajanahally S, Kovac JR, Smith RP, Pastuszak AW, et al. Anabolic steroid induced hypogonadism in young men. J Urol. 2013;190:2200–5. [PubMed] [Google Scholar]
-
Evans NA. Gym and tonic: a profile of 100 male steroid users. Br J Sports Med. 1997;31:54–8.[PMC free article] [PubMed] [Google Scholar]
-
Parr MK, Flenker U, Schanzer W. Sports-related issues and biochemistry of natural and synthetic anabolic substances. Endocrinol Metab Clin North Am. 2010;39:45–57. viii. [PubMed] [Google Scholar]
-
Pope HG, Kanayama G, Ionescu-Pioggia M, Hudson JI. Anabolic steroid users’ attitudes towards physicians. Addiction. 2004;99:1189–94. [PubMed] [Google Scholar]
-
Liu PY, Swerdloff RS, Christenson PD, Handelsman DJ, Wang C. Rate, extent, and modifiers of spermatogenic recovery after hormonal male contraception: an integrated analysis. Lancet. 2006;367:1412–20. [PubMed] [Google Scholar]
-
Boregowda K, Joels L, Stephens JW, Price DE. Persistent primary hypogonadism associated with anabolic steroid abuse. Fertil Steril. 2011;96:e7–8. [PubMed] [Google Scholar]
-
Jarow JP, Lipshultz LI. Anabolic steroid-induced hypogonadotropic hypogonadism. Am J Sports Med. 1990;18:429–31. [PubMed] [Google Scholar]
-
Moss JL, Crosnoe LE, Kim ED. Effect of rejuvenation hormones on spermatogenesis. Fertil Steril. 2013;99:1814–20. [PubMed] [Google Scholar]
-
Kovac JR, Addai J, Smith RP, Coward RM, Lamb DJ, et al. The effects of advanced paternal age on fertility. Asian J Androl. 2013;15:723–8. [PMC free article] [PubMed] [Google Scholar]
-
Schwarzer JU. Vasectomy reversal using a microsurgical three-layer technique: one surgeon’s experience over 18 years with 1300 patients. Int J Androl. 2012;35:706–13. [PubMed] [Google Scholar]
-
Baker J, Hardy MP, Zhou J, Bondy C, Lupu F, et al. Effects of an Igf1 gene null mutation on mouse reproduction. Mol Endocrinol. 1996;10:903–18. [PubMed] [Google Scholar]
-
Wang G, Hardy MP. Development of Leydig cells in the insulin-like growth factor-I (igf-I) knockout mouse: effects of igf-I replacement and gonadotropic stimulation. Biol Reprod. 2004;70:632–9. [PubMed] [Google Scholar]
-
Dohle GR, Smit M, Weber RF. Androgens and male fertility. World J Urol. 2003;21:341–5. [PubMed] [Google Scholar]
-
Anawalt BD, Bebb RA, Matsumoto AM, Groome NP, Illingworth PJ, et al. Serum inhibin B levels reflect Sertoli cell function in normal men and men with testicular dysfunction. J Clin Endocrinol Metab. 1996;81:3341–5. [PubMed] [Google Scholar]
-
Finkel DM, Phillips JL, Snyder PJ. Stimulation of spermatogenesis by gonadotropins in men with hypogonadotropic hypogonadism. N Engl J Med. 1985;313:651–5. [PubMed] [Google Scholar]
-
Nieschlag E, Simoni M, Gromoll J, Weinbauer GF. Role of FSH in the regulation of spermatogenesis: clinical aspects. Clin Endocrinol. 1999;51:139–46. [PubMed] [Google Scholar]
-
Jarow JP, Zirkin BR. The androgen microenvironment of the human testis and hormonal control of spermatogenesis. Ann N Y Acad Sci. 2005;1061:208–20. [PubMed] [Google Scholar]
-
Kumar TR. What have we learned about gonadotropin function from gonadotropin subunit and receptor knockout mice? Reproduction. 2005;130:293–302. [PubMed] [Google Scholar]
-
Marchetti C, Hamdane M, Mitchell V, Mayo K, Devisme L, et al. Immunolocalization of inhibin and activin alpha and betaB subunits and expression of corresponding messenger RNAs in the human adult testis. Biol Reprod. 2003;68:230–5. [PubMed] [Google Scholar]
-
Ettore C. Male hypothalamic-pituitary-gonadal axis. In: Larry IL, Stuart SH, Craig SN, editors. Infertility in the Male. 4th ed. Cambridge, UK: Cambridge University Press; 2009. pp. 14–28. [Google Scholar]
-
MacIndoe JH, Perry PJ, Yates WR, Holman TL, Ellingrod VL, et al. Testosterone suppression of the HPT axis. J Investig Med. 1997;45:441–7. [PubMed] [Google Scholar]
-
Ly LP, Liu PY, Handelsman DJ. Rates of suppression and recovery of human sperm output in testosterone-based hormonal contraceptive regimens. Hum Reprod. 2005;20:1733–40. [PubMed] [Google Scholar]
-
Gu Y, Liang X, Wu W, Liu M, Song S, et al. Multicenter contraceptive efficacy trial of injectable testosterone undecanoate in Chinese men. J Clin Endocrinol Metab. 2009;94:1910–5. [PubMed] [Google Scholar]
-
Manetti GJ, Honig SC. Update on male hormonal contraception: is the vasectomy in jeopardy? Int J Impot Res. 2010;22:159–70. [PubMed] [Google Scholar]
-
de Souza GL, Hallak J. Anabolic steroids and male infertility: a comprehensive review. BJU Int. 2011;108:1860–5. [PubMed] [Google Scholar]
-
Rahnema CD, Lipshultz LI, Crosnoe LE, Kovac JR, Kim ED. Anabolic steroid-induced hypogonadism: diagnosis and treatment. Fertil Steril. 2014;101:1271–9. [PubMed] [Google Scholar]
-
Boyadjiev NP, Georgieva KN, Massaldjieva RI, Gueorguiev SI. Reversible hypogonadism and azoospermia as a result of anabolic-androgenic steroid use in a bodybuilder with personality disorder. A case report. J Sports Med Phys Fitness. 2000;40:271–4. [PubMed] [Google Scholar]
-
Turek PJ, Williams RH, Gilbaugh JH, 3rd, Lipshultz LI. The reversibility of anabolic steroid-induced azoospermia. J Urol. 1995;153:1628–30. [PubMed] [Google Scholar]
-
Gazvani MR, Buckett W, Luckas MJ, Aird IA, Hipkin LJ, et al. Conservative management of azoospermia following steroid abuse. Hum Reprod. 1997;12:1706–8. [PubMed] [Google Scholar]
-
Liu PY, Turner L, Rushford D, McDonald J, Baker HW, et al. Efficacy and safety of recombinant human follicle stimulating hormone (Gonal-F) with urinary human chorionic gonadotrophin for induction of spermatogenesis and fertility in gonadotrophin-deficient men. Hum Reprod. 1999;14:1540–5. [PubMed] [Google Scholar]
-
Trinchard-Lugan I, Khan A, Porchet HC, Munafo A. Pharmacokinetics and pharmacodynamics of recombinant human chorionic gonadotrophin in healthy male and female volunteers. Reprod Biomed Online. 2002;4:106–15. [PubMed] [Google Scholar]
-
Lehert P, Schertz JC, Ezcurra D. Recombinant human follicle-stimulating hormone produces more oocytes with a lower total dose per cycle in assisted reproductive technologies compared with highly purified human menopausal gonadotrophin: a meta-analysis. Reprod Biol Endocrinol. 2010;8:112.[PMC free article] [PubMed] [Google Scholar]
-
Farhat R, Al-zidjali F, Alzahrani AS. Outcome of gonadotropin therapy for male infertility due to hypogonadotrophic hypogonadism. Pituitary. 2010;13:105–10. [PubMed] [Google Scholar]
-
Buchter D, Behre HM, Kliesch S, Nieschlag E. Pulsatile GnRH or human chorionic gonadotropin/human menopausal gonadotropin as effective treatment for men with hypogonadotropic hypogonadism: a review of 42 cases. Eur J Endocrinol. 1998;139:298–303. [PubMed] [Google Scholar]
-
Pitteloud N, Hayes FJ, Dwyer A, Boepple PA, Lee H, et al. Predictors of outcome of long-term GnRH therapy in men with idiopathic hypogonadotropic hypogonadism. J Clin Endocrinol Metab. 2002;87:4128–36. [PubMed] [Google Scholar]
-
Rastrelli G, Corona G, Mannucci E, Maggi M. Factors affecting spermatogenesis upon gonadotropin-replacement therapy: a meta-analytic study. Andrology. 2014;2:794–808. [PubMed] [Google Scholar]
-
Liu PY, Baker HW, Jayadev V, Zacharin M, Conway AJ, et al. Induction of spermatogenesis and fertility during gonadotropin treatment of gonadotropin-deficient infertile men: predictors of fertility outcome. J Clin Endocrinol Metab. 2009;94:801–8. [PubMed] [Google Scholar]
-
Schaison G, Young J, Pholsena M, Nahoul K, Couzinet B. Failure of combined follicle-stimulating hormone-testosterone administration to initiate and/or maintain spermatogenesis in men with hypogonadotropic hypogonadism. J Clin Endocrinol Metab. 1993;77:1545–9. [PubMed] [Google Scholar]
-
Vicari E, Mongioi A, Calogero AE, Moncada ML, Sidoti G, et al. Therapy with human chorionic gonadotrophin alone induces spermatogenesis in men with isolated hypogonadotrophic hypogonadism – Long-term follow-up. Int J Androl. 1992;15:320–9. [PubMed] [Google Scholar]
-
Efficacy and safety of highly purified urinary follicle-stimulating hormone with human chorionic gonadotropin for treating men with isolated hypogonadotropic hypogonadism. European Metrodin HP Study Group. Fertil Steril. 1998;70:256–62. [PubMed] [Google Scholar]
-
Bouloux PM, Nieschlag E, Burger HG, Skakkebaek NE, Wu FC, et al. Induction of spermatogenesis by recombinant follicle-stimulating hormone (puregon) in hypogonadotropic azoospermic men who failed to respond to human chorionic gonadotropin alone. J Androl. 2003;24:604–11. [PubMed] [Google Scholar]
-
Burger HG, Baker HW. Therapeutic considerations and results of gonadotropin treatment in male hypogonadotropic hypogonadism. Ann N Y Acad Sci. 1984;438:447–53. [PubMed] [Google Scholar]
-
Burgues S, Calderon MD. Subcutaneous self-administration of highly purified follicle stimulating hormone and human chorionic gonadotrophin for the treatment of male hypogonadotrophic hypogonadism. Spanish Collaborative Group on Male Hypogonadotropic Hypogonadism. Hum Reprod. 1997;12:980–6.[PubMed] [Google Scholar]
-
Ishikawa T, Ooba T, Kondo Y, Yamaguchi K, Fujisawa M. Assessment of gonadotropin therapy in male hypogonadotropic hypogonadism. Fertil Steril. 2007;88:1697–9. [PubMed] [Google Scholar]
-
Miyagawa Y, Tsujimura A, Matsumiya K, Takao T, Tohda A, et al. Outcome of gonadotropin therapy for male hypogonadotropic hypogonadism at university affiliated male infertility centers: a 30-year retrospective study. J Urol. 2005;173:2072–5. [PubMed] [Google Scholar]
-
Burris AS, Clark RV, Vantman DJ, Sherins RJ. A low sperm concentration does not preclude fertility in men with isolated hypogonadotropic hypogonadism after gonadotropin therapy. Fertil Steril. 1988;50:343–7. [PubMed] [Google Scholar]
-
Liu PY, Gebski VJ, Turner L, Conway AJ, Wishart SM, et al. Predicting pregnancy and spermatogenesis by survival analysis during gonadotrophin treatment of gonadotrophin-deficient infertile men. Hum Reprod. 2002;17:625–33. [PubMed] [Google Scholar]
-
Coviello AD, Matsumoto AM, Bremner WJ, Herbst KL, Amory JK, et al. Low-dose human chorionic gonadotropin maintains intratesticular testosterone in normal men with testosterone-induced gonadotropin suppression. J Clin Endocrinol Metab. 2005;90:2595–602. [PubMed] [Google Scholar]
-
Depenbusch M, von Eckardstein S, Simoni M, Nieschlag E. Maintenance of spermatogenesis in hypogonadotropic hypogonadal men with human chorionic gonadotropin alone. Eur J Endocrinol. 2002;147:617–24. [PubMed] [Google Scholar]
-
Hsieh TC, Pastuszak AW, Hwang K, Lipshultz LI. Concomitant intramuscular human chorionic gonadotropin preserves spermatogenesis in men undergoing testosterone replacement therapy. J Urol. 2013;189:647–50. [PubMed] [Google Scholar]
-
Wenker EP, Dupree JM, Langille GM, Kovac J, Ramasamy R, et al. The use of HCG-based combination therapy for recovery of spermatogenesis after testosterone use. J Sex Med. 2015;12:1334–7.[PubMed] [Google Scholar]
-
Coward RM, Mata DA, Smith RP, Kovac JR, Lipshultz LI. Vasectomy reversal outcomes in men previously on testosterone supplementation therapy. Urology. 2014;84:1335–40. [PubMed] [Google Scholar]
-
Gill GV. Anabolic steroid induced hypogonadism treated with human chorionic gonadotropin. Postgrad Med J. 1998;74:45–6. [PMC free article] [PubMed] [Google Scholar]
-
Menon DK. Successful treatment of anabolic steroid-induced azoospermia with human chorionic gonadotropin and human menopausal gonadotropin. Fertil Steril. 2003;79(Suppl 3):1659–61. [PubMed] [Google Scholar]
-
Goldstein SR, Siddhanti S, Ciaccia AV, Plouffe L., Jr A pharmacological review of selective oestrogen receptor modulators. Hum Reprod Update. 2000;6:212–24. [PubMed] [Google Scholar]
-
Kim ED, Crosnoe L, Bar-Chama N, Khera M, Lipshultz LI. The treatment of hypogonadism in men of reproductive age. Fertil Steril. 2013;99:718–24. [PubMed] [Google Scholar]
-
Shelly W, Draper MW, Krishnan V, Wong M, Jaffe RB. Selective estrogen receptor modulators: an update on recent clinical findings. Obstet Gynecol Surv. 2008;63:163–81. [PubMed] [Google Scholar]
-
Mellinger RC, Thompson RJ. The effect of clomiphene citrate in male infertility. Fertil Steril. 1966;17:94–103. [PubMed] [Google Scholar]
-
Micic S, Dotlic R. Evaluation of sperm parameters in clinical trial with clomiphene citrate of oligospermic men. J Urol. 1985;133:221–2. [PubMed] [Google Scholar]
-
Check JH, Chase JS, Nowroozi K, Wu CH, Adelson HG. Empirical therapy of the male with clomiphene in couples with unexplained infertility. Int J Fertil. 1989;34:120–2. [PubMed] [Google Scholar]
-
Katz DJ, Nabulsi O, Tal R, Mulhall JP. Outcomes of clomiphene citrate treatment in young hypogonadal men. BJU Int. 2012;110:573–8. [PubMed] [Google Scholar]
-
Shabsigh A, Kang Y, Shabsign R, Gonzalez M, Liberson G, et al. Clomiphene citrate effects on testosterone/estrogen ratio in male hypogonadism. J Sex Med. 2005;2:716–21. [PubMed] [Google Scholar]
-
Taylor F, Levine L. Clomiphene citrate and testosterone gel replacement therapy for male hypogonadism: efficacy and treatment cost. J Sex Med. 2010;7:269–76. [PubMed] [Google Scholar]
-
Ghanem H, Shaeer O, El-Segini A. Combination clomiphene citrate and antioxidant therapy for idiopathic male infertility: a randomized controlled trial. Fertil Steril. 2010;93:2232–5. [PubMed] [Google Scholar]
-
Hussein A, Ozgok Y, Ross L, Niederberger C. Clomiphene administration for cases of nonobstructive azoospermia: a multicenter study. J Androl. 2005;26:787–91. [PubMed] [Google Scholar]
-
Liu PY, Handelsman DJ. The present and future state of hormonal treatment for male infertility. Hum Reprod Update. 2003;9:9–23. [PubMed] [Google Scholar]
-
Kaminetsky J, Hemani ML. Clomiphene citrate and enclomiphene for the treatment of hypogonadal androgen deficiency. Expert Opin Investig Drugs. 2009;18:1947–55. [PubMed] [Google Scholar]
-
Moskovic DJ, Katz DJ, Akhavan A, Park K, Mulhall JP. Clomiphene citrate is safe and effective for long-term management of hypogonadism. BJU Int. 2012;110:1524–8. [PubMed] [Google Scholar]
-
Pasqualotto FF, Fonseca GP, Pasqualotto EB. Azoospermia after treatment with clomiphene citrate in patients with oligospermia. Fertil Steril. 2008;90:2014.e11–2. [PubMed] [Google Scholar]
-
Bickelman C, Ferries L, Eaton RP. Impotence related to anabolic steroid use in a body builder. Response to clomiphene citrate. West J Med. 1995;162:158–60. [PMC free article] [PubMed] [Google Scholar]
-
Tan RS, Vasudevan D. Use of clomiphene citrate to reverse premature andropause secondary to steroid abuse. Fertil Steril. 2003;79:203–5. [PubMed] [Google Scholar]
-
Whitten SJ, Nangia AK, Kolettis PN. Select patients with hypogonadotropic hypogonadism may respond to treatment with clomiphene citrate. Fertil Steril. 2006;86:1664–8. [PubMed] [Google Scholar]
-
Hill S, Arutchelvam V, Quinton R. Enclomiphene, an estrogen receptor antagonist for the treatment of testosterone deficiency in men. IDrugs. 2009;12:109–19. [PubMed] [Google Scholar]
-
Kaminetsky J, Werner M, Fontenot G, Wiehle RD. Oral enclomiphene citrate stimulates the endogenous production of testosterone and sperm counts in men with low testosterone: comparison with testosterone gel. J Sex Med. 2013;10:1628–35. [PubMed] [Google Scholar]
-
Wiehle R, Cunningham GR, Pitteloud N, Wike J, Hsu K, et al. Testosterone restoration by enclomiphene citrate in men with secondary hypogonadism: pharmacodynamics and pharmacokinetics. BJU Int. 2013 doi: 10.1111/bju.12363, Epub ahead of print. [PMC free article] [PubMed] [Google Scholar]
-
Wiehle RD, Fontenot GK, Wike J, Hsu K, Nydell J, et al. Enclomiphene citrate stimulates testosterone production while preventing oligospermia: a randomized phase II clinical trial comparing topical testosterone. Fertil Steril. 2014;102:720–7. [PubMed] [Google Scholar]
-
Clark RV, Sherins RJ. Treatment of men with idiopathic oligozoospermic infertility using the aromatase inhibitor, testolactone. Results of a double-blinded, randomized, placebo-controlled trial with crossover. J Androl. 1989;10:240–7. [PubMed] [Google Scholar]
-
Raman JD, Schlegel PN. Aromatase inhibitors for male infertility. J Urol. 2002;167:624–9. [PubMed] [Google Scholar]
-
Cakan M, Aldemir M, Topcuoglu M, Altug U. Role of testosterone/estradiol ratio in predicting the efficacy of tamoxifen citrate treatment in idiopathic oligoasthenoteratozoospermic men. Urol Int. 2009;83:446–51. [PubMed] [Google Scholar]
-
Ramasamy R, Ricci JA, Palermo GD, Gosden LV, Rosenwaks Z, et al. Successful fertility treatment for Klinefelter’s syndrome. J Urol. 2009;182:1108–13. [PubMed] [Google Scholar]
-
Saylam B, Efesoy O, Cayan S. The effect of aromatase inhibitor letrozole on body mass index, serum hormones, and sperm parameters in infertile men. Fertil Steril. 2011;95:809–11. [PubMed] [Google Scholar]
-
Helo S, Ellen J, Mechlin C, Feustel P, Grossman M, et al. A randomized prospective double-blind comparison trial of clomiphene citrate and anastrozole in raising testosterone in hypogonadal infertile men. J Sex Med. 2015;12:1761–9. [PubMed] [Google Scholar]
-
Burnett-Bowie SA, Roupenian KC, Dere ME, Lee H, Leder BZ. Effects of aromatase inhibition in hypogonadal older men: a randomized, double-blind, placebo-controlled trial. Clin Endocrinol. 2009;70:116–23. [PubMed] [Google Scholar]
-
Burnett-Bowie SA, McKay EA, Lee H, Leder BZ. Effects of aromatase inhibition on bone mineral density and bone turnover in older men with low testosterone levels. J Clin Endocrinol Metab. 2009;94:4785–92. [PMC free article] [PubMed] [Google Scholar]


 por tu tiempo y enhorabuena
por tu tiempo y enhorabuena