Los esteroides anabólicos fueron incorporados por la Comisión Médica del Comité Olímpico Internacional (COI) en la Lista de Sustancias Prohibidas en el año 1974. La primera técnica empleada para su detección fue la de radioinmunoensayo, la cual no permaneció por mucho tiempo debido a la desventaja de presentar reacciones cruzadas con muchos compuestos estructuralmente similares y que se encuentran fisiológicamente en la orina.
La introducción de la Espectrometría de Masas acoplada a la Cromatografía de Gases para la detección e identificación de los esteroides anabólicos realizada por el Prof. M. Donike, indiscutiblemente marcó una nueva etapa en el análisis de muestras para el control doping.
Una vez introducido y desarrollado este método, la detección de estos compuestos dejó de constituir un problema para los laboratorios. Esto provocó en los atletas la reacción de sustituir los compuestos exógenos por aquellos que presentan igualmente acción androgénica pero que se excretan de forma fisiológica en la orina. De esta manera, surgió un nuevo reto para los laboratorios.
El primer esteroide endógeno utilizado por los atletas fue la testosterona, después de varios estudios, se observó que con la administración de testosterona, aumentan considerablemente las concentraciones de testosterona, androsterona y etiocolanolona en forma de conjugados glucurónidos en la orina entre otros metabolitos de esta hormona. Otra observación de gran importancia fue que la epitestosterona, hormona sin valor androgénico y que se excreta de manera fisiológica en una relación aproximada de 1 : 1 con respec-
to a la testosterona, se mantiene inalterable luego de una administra-
ción de esta última. Es por ello que en 1982, la Comisión Médica del COI (y actualmente la Agencia Mundial Antidopaje, AMA) decide que una relación testosterona/epitestosterona mayor de 6 : 1 sería considerada una violación de las reglas del olimpismo (entonces los atletas comenzaron el uso de epitestosterona para equilibrar dicha relación).
Estudios posteriores demostraron la influencia que ejercen, sobre el perfil de esteroides endógenos urinarios, la administración de los
esteroides anabólicos sintéticos. La administración de estos compuestos (vía oral, parenteral, tópica o cualquier otra) provoca una depresión de las concentraciones de los esteroides endógenos urinarios debido a su acción sobre la homeostasis de la biosíntesis de esteroides y su metabolismo en el organismo humano.
Se conoce que luego de una administración a largo plazo de esteroides sintéticos, las concentraciones de los compuestos endógenos urinarios regresan a su nivel basal en un tiempo superior al de la eliminación del esteroide administrado. Este hecho hace de la evaluación del perfil de esteroides urinarios una herramienta útil en el diagnóstico del consumo de esteroides anabólicos.
Los resultados de la aplicación de los métodos analíticos en el laboratorio imponen una gran responsabilidad debido a las implicaciones que ellos traen aparejadas.
Por ello, esos resultados deben ser muy confiables, luego si se tiene en cuenta que los análisis están sometidos a múltiples fuentes de error (tanto evitables como inevitables), entonces, no basta con trabajar con máximo cuidado, sino que cada laboratorio necesita un sistema bien establecido y organizado para controlar permanentemente la precisión y exactitud de sus análisis de manera objetiva.
MATERIALES Y MÉTODOS
Reactivos
-β-Glucuronidasa/tipo K12 E. coli (Roche, Alemania);
-Metanol pureza 99,93 % (SIGMA, Alemania);
-Tert-butilmetileter, pureza 99,8 % (SIGMA,Alemania);
-N-metil-N-trimetilsililtri-fluoro-acetamida para CG (MSTFA),(SIGMA, Alemania);
-Ioduro deamonio, pureza 100,7 % (SIGMAChemical, Alemania);
-2-mercap-toetanol (Merck, Alemania);
-Columnas de extracción en fase sólida Detectabuse TM (Biochemical Diagnostics, EE. UU.).
En cada lote analítico (25 muestras), se utilizan dos controles posi-
tivos.
El primero lo constituye un blanco de orina contaminado con los
compuestos que se excretan en baja concentración y que el AMA exige su detección hasta 2 ng/mL (metabolito 1 nandrolona, el metabolito 2 de la metiltestosterona, el metabolito 1 del stanozolol, clenbuterol y el metabolito 3 de la metandienona).
El segundo, es un blanco de orina contaminado con 29 compuestos que garantizan el control de la retención relativa de los compuestos en general, a detectar. Los controles negativos utilizados durante el proceso de pesquizaje son:
-Blanco del reactivo empleado para la formación de derivados.
-Blanco de orina previamente verificado en el que no se encontraron interferencias a los tiempos de retención de los compuestos a identificar en el proceso de pesquizaje y dotado de esteroides endógenos en concentraciones bien establecidas.
La muestra calibradora empleada contiene 20 esteroides endógenos en concentraciones conocidas y con ayuda del programa empleado es posible calcular mediante factores de respuesta,
sus concentraciones en cada una de las muestras analizadas. El patrón interno (PI) utilizado en esta técnica consiste en una mezcla de 17
α-metiltestosterona (50 μg/mL) y (16,16,17-d3)-testosterona (5 μg/mL). Este último, se incorpora con el objetivo de realizar la cuantificación de la testosterona y epitestosterona en cada muestra, así como de otros compuestos endógenos que se encuentren en concentraciones similares.
Cada uno de los controles descritos anteriormente es procesado en
conjunto con las muestras en cada lote analítico.
El método de extracción consiste en pasar la muestra por una co-
lumna de extracción en fase sólida Detectabuse TM previamente activada con 2 mL de metanol y 2 mL de agua desionizada. Después de adicionada la muestra se realiza un lavado con 2 mL de agua desionizada y los compuestos adsorbidos en la columna son eluidos con 2 mL de metanol. Posteriormente, el metanol es evaporado a sequedad y el extracto es reconstituido con 1 mL de disolución reguladora de fosfato pH = 7,0.
La hidrólisis se realiza con β-glucuronidasa (E. coli), 25 unidades
/muestra, a 55 °C durante 1 h . Después de alcanzar la temperatura
ambiente, se realiza una extracción líquido-líquido con tert-butilmetil-éter luego de realizar un ajuste de pH con 250 μL de K2CO3 (5 %). Se separa a fase orgánica y se evapora com-
pletamente. La reacción para la formación de derivados trimetilsilil (TMS) se realiza con una mezcla de MSTFA-NH4I- 2-mercaptoetanol (v
/m/v) (1 000 : 2 : 6). Los compuestos bis-O-TMS, tris-O-TMS y Tetrakis-O-TMS son formados en dependencia del número de grupos funcionales que presenta cada compuesto, capaCes de reaccionar con el grupo TMS.
RESULTADOS Y DISCUSIÓN
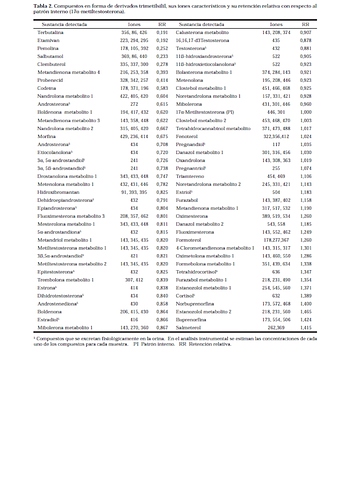
Con la utilización de esta técnica es posible detectar en una sola corrida cromatográfica 76 compuestos en su forma de derivados trimetilsilil. La Tabla 2 muestra los compuestos objeto de análisis, así como sus iones diagnóstico en orden decreciente de intensidad y la retención relativa de cada uno de ellos. El empleo del modo de adquisición monitoreo selectivo de iones en la técnica de CG-EM permite aumentar la sensibilidad y la posibilidad de pesquisar un gran
número de compuestos basándose en la verificación de iones
característicos, en una sola corrida.
Hidrólisis enzimática
La hidrólisis enzimática es uno de los pasos más importantes dentro del proceso de preparación de la muestra debido a que los esteroides anabólicos, ya sean endógenos o exógenos, se excretan en forma de conjugados (glucurónidos en su mayoría). Por tanto, se hace necesaria la separación del grupo glucurónido de la molécula mediante una hidrólisis al nivel de la posición β de los carbonos 3 y 17 para su análisis instrumental. El control interno de este paso se realiza mediante la utilización de cartas simples de control.
Reacción de formación de derivados
Como toda reacción química surendimiento es afectado por múltiples factores como son: tiempo, temperatura de reacción y humedad, fundamentalmente. El control de esta reacción se realiza a través de la verificación del monoderivado-O-TMS de laandrosterona. El área para el ión m/z 272 correspondiente al derivado mono-O-TMS de este compuesto no debe exceder del 5 % del área correspondiente al ión m/z 434 de la androsterona bis-O-TMS.
En la orina se encuentran una gran cantidad de bacterias propias
de la flora. Cuando la muestra no es conservada en condiciones apropiadas se favorece el crecimiento de ellas, tomando como sustrato los propios esteroides endógenos que se encuentran en el medio. Esto trae como consecuencia una alteración del perfil que puede llevar a pensar en un resultado analítico adverso. Para descartar una posible contaminación por estas bacterias
es verificada la presencia de 5α- y 5β-androstandiona. La presencia de
ambos compuestos en la muestra de orina lleva a pensar en una posible contaminación bacteriana, mientras que la existencia de la 5
α-androstandiona solamente, puede llevar a pensar en un consumo de este precursor de la testosterona.
CONCLUSIONES
Esta metodología analítica implementada permite la detección de 76 compuestos en una sola corrida cromatográfica. El uso de controles
positivos y negativos garantiza la detección de los compuestos analizados. El sistema de control de cada uno de los pasos establecidos en el procedimiento analítico permite que los resultados obtenidos tengan un alto grado de confiabilidad.