Resulta llamativa la relativa constancia de los líquidos corporales ya que hay un intercambio continuo de líquido y solutos con el ambiente externo, así como dentro de los diferentes compartimientos del cuerpo.
Ingestión diaria de agua
El agua ingresa en el cuerpo a través de dos fuentes principales:
- se ingiere en forma de líquidos o agua del alimento, y
- se sintetiza en el cuerpo como resultado de la oxidación de los hidratos de carbono.
La ingestión de agua es muy variable entre las diferentes personas e incluso dentro de la misma persona en diferentes días en función del clima, los hábitos e incluso el grado de actividad física.
Pérdida diaria de agua corporal
Pérdida insensible de agua
Parte de las pérdidas de agua no pueden regularse de manera precisa. Por ejemplo, hay una pérdida continua de agua por evaporación de las vías respiratorias y difusión a través de la piel, lo que juntas son responsables de alrededor de 700 ml/día de pérdida de agua en condiciones normales. A esto se le denomina pérdida insensible de agua porque no somos conscientes de ella, aunque se produzca continuamente en todos los seres humanos vivos.
La pérdida insensible de agua a través de la piel es independiente de la sudoración y está presente incluso en personas que nacen sin glándulas sudoríparas; la pérdida media de agua por difusión a través de la piel es de unos 300-400 ml/día. Esta pérdida la minimiza la capa cornificada llena de colesterol de la piel, que constituye una barrera contra la pérdida excesiva por difusión.
Cuando la capa cornificada se pierde, como ocurre en las quemaduras extensas, la intensidad de la evaporación puede aumentar hasta 10 veces, hasta unos 3-5 L/día. Por esta razón, las víctimas de quemaduras deben recibir grandes cantidades de líquido, habitualmente por vía intravenosa, para equilibrar su pérdida.
La pérdida insensible de agua a través de la vía respiratoria es de unos 300-400 ml/día. A medida que el aire entra en la vía respiratoria, se satura de humedad hasta una presión de agua de unos 47 mmHg hasta que se espira. Como la presión de vapor del aire inspirado suele ser menor de 47 mmHg, el agua se pierde continuamente a través de los pulmones con la respiración.
En el clima frío, la presión de vapor atmosférica se reduce a casi 0, lo que provoca una pérdida pulmonar de agua incluso mayor a medida que la temperatura se reduce. Esto explica la sensación de sequedad en las vías respiratorias en el clima frío.
Pérdida de líquido en el sudor
La cantidad de agua perdida por el sudor es muy variable dependiendo de la actividad física y de la temperatura ambiental. El volumen de sudor es normalmente de unos 100 ml/día, pero en un clima muy cálido o durante el ejercicio intenso, la pérdida de agua en el sudor aumenta en ocasiones hasta 1-2 L/h. Esto vaciaría rápidamente los líquidos corporales si la ingestión no aumentara mediante la activación del mecanismo de la sed .
Pérdida de agua en las heces
Sólo se pierde normalmente una pequeña cantidad de agua (100 ml/día) en las heces. Esto puede aumentar a varios litros al día en personas con diarrea intensa. Por esta razón la diarrea intensa puede poner en peligro la vida si no se corrige en unos días.
Pérdida de agua por los riñones
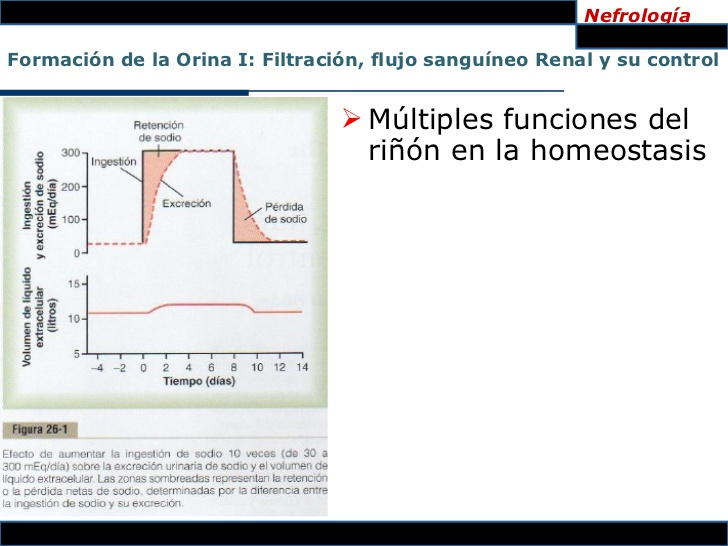
El resto del agua perdida se excreta en la orina por los riñones. Hay múltiples mecanismos que controlan la intensidad de la producción de orina. De hecho, el medio más importante por el que el cuerpo mantiene un equilibrio entre los ingresos y las pérdidas, así como el equilibrio entre el ingreso y la salida de la mayoría de los electrólitos en el cuerpo, es controlando la intensidad con la que los riñones excretan estas sustancias. Por ejemplo, el volumen de orina puede ser tan sólo de 0,5 l/día en una persona deshidratada o tan alta como de 20 l/día en una persona que ha bebido cantidades enormes de agua.
Esta variabilidad en la ingestión también es cierta para la mayoría de los electrólitos del cuerpo, como el sodio, el cloro y el potasio. En algunas personas, la ingestión de sodio puede ser tan sólo de 20mEq/día, mientras que en otros puede ser tan alta como de 300-500 mEq/día. Los riñones se enfrentan a la tarea de ajustar la intensidad de la excreción de agua y electrólitos para que se equipare de manera precisa con la ingestión de estas sustancias, así como de compensar las pérdidas excesivas de líquidos y electrólitos que se producen en ciertos estados morbosos.
Compartimentos del líquido corporal
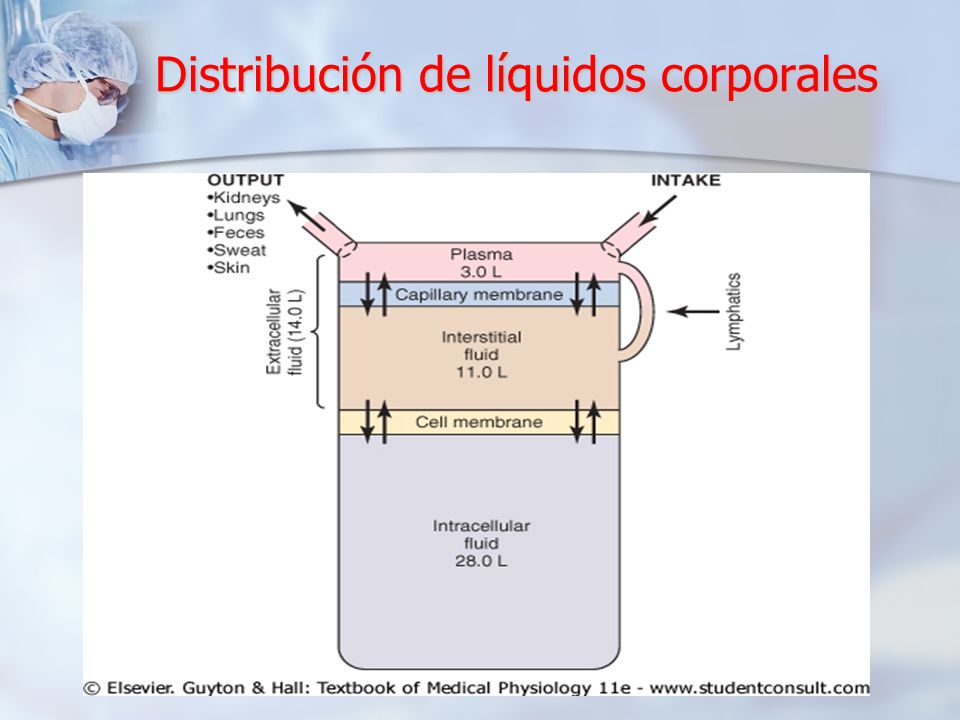
El líquido corporal total se distribuye sobre todo entre dos compartimientos: el líquido extracelular y el líquido intracelular.
El líquido extracelular se divide en el líquido intersticial y el plasma sanguíneo.Existe otro pequeño compartimiento de líquido que se denomina líquido transcelular. Este compartimiento comprende el líquido de los espacios sinovial, peritoneal, pericárdico e intracelular, así como el líquido cefalorraquídeo; suele considerarse un tipo especializado de líquido extracelular, aunque en algunos casos su composición puede diferir de forma acentuada de la del plasma o de la del líquido intersticial. Todos los líquidos transcelulares constituyen alrededor de 1 a 2 L.
En el varón adulto medio de 70 kg, el agua corporal total es alrededor del 60% del peso corporal o unos 42 L. Este porcentaje puede cambiar dependiendo de la edad, el sexo y el grado de obesidad. A medida que una persona envejece, el porcentaje del agua corporal total que es líquido se reduce gradualmente. Esto se debe en parte al hecho de que el envejecimiento suele acompañarse de un aumento del porcentaje del peso corporal que es grasa, lo que reduce el porcentaje de agua en el cuerpo.
Debido a que las mujeres tienen normalmente más grasa corporal que los varones, sus promedios totales de agua en el organismo son aproximadamente de un 50% del peso corporal. En bebés prematuros y neonatos, el agua total en el organismo está situada en el 70-75% del peso corporal. Luego, cuando se comenten los compartimientos «medios» de líquido corporal, deberemos tener en cuenta que hay variaciones dependiendo de la edad, el sexo y el porcentaje de grasa corporal.
Compartimento del líquido intracelular
Alrededor de 28 a 42L de líquido corporal están dentro de los 100 billones de células y se le denomina en conjunto líquido intracelular.
Luego el líquido intracelular constituye alrededor del 40% del peso corporal total en una persona «media».El líquido de cada célula contiene su mezcla individual de diferentes constituyentes, pero las concentraciones de estas sustancias son similares de una célula a otra. De hecho, la composición de los líquidos celulares es muy similar incluso en animales diferentes, desde los microorganismos más primitivos a los seres humanos. Por esta razón, el líquido intracelular de todas las células juntas se considera un solo gran compartimiento de líquido.
Compartimento del líquido extracelular
Todos los líquidos del exterior de las células se denominan en conjunto líquido extracelular. Todos estos líquidos constituyen alrededor del 20% del peso corporal, o unos 14L en un varón adulto normal de 70 kg.
Los dos compartimientos más grandes del líquido extracelular son el líquido intersticial, que se supone hasta más de tres cuartas partes (11L) del líquido extracelular, y el plasma, que supone casi una cuarta parte del liquido extracelular o unos 3L. El plasma es la parte no celular de la sangre; intercambia sustancias continuamente con el líquido intersticial a través de poros de las membranas capilares.
Estos poros son muy permeables a casi todos solutos del líquido extracelular excepto a las proteínas. Los líquidos extracelulares se están mezclando constantemente, de manera que el plasma y el líquido intersticial tienen casi la misma composición excepto en lo referente a las proteínas, que están más concentradas en el plasma.
Regulación del intercambio de líquido y del equilibrio osmótico entre los líquidos intracelular y extracelular
Las cantidades relativas de líquido extracelular distribuidas entre los espacios plasmático e intersticial están determinadas sobre todo por el equilibrio entre las fuerzas hidrostática y coloidosmótica a través de las membranas capilares.
La distribución del líquido entre los com partimentos intracelular y extracelular, en cambio, está determinada sobre todo por el efecto osmótico de los solutos más pequeños (en especial el sodio, el cloro y otros electrólitos) que actúan a través de la membrana celular. La razón de esto es que la membrana celular es muy permeable al agua pero relativamente impermeable incluso a iones pequeños, como el sodio y el cloro.
Principios básicos de la osmosis y la presión osmótica
La osmosis es la difusión neta de agua a través de una membrana con una permeabilidad selectiva desde una región con una concentración alta de agua a otra que tiene una concentración baja. Cuando se añade un soluto al agua pura, esto reduce la concentración de agua en la mezcla. De este modo, cuanto mayor sea la concentración de soluto en una dilución, menor será la concentración de agua.
Además, el agua difunde de una región con una concentración baja de soluto (concentración alta de agua) a otra con una concentración alta de soluto (concentración baja de agua). Debido a que las membranas celulares son relativamente impermeables a la mayoría de los solutos pero muy permeables al agua (es decir, permeabilidad selectiva), donde quiera que haya una mayor concentración de soluto a un lado de la membrana celular, el agua se difundirá a través de la membrana hacia la región de mayor concentración de soluto.
Luego si se añade un soluto como el cloruro de sodio al líquido extracelular, el agua difundirá rápidamente desde las células a través de las membranas celulares hacia el líquido extracelular hasta que la concentración de agua en los dos lados se iguale.
Por el contrario, si es extrae un soluto como el cloruro de sodio del líquido extracelular, el agua difunde desde el líquido extracelular a través de las membranas celulares y hacia el interior de las células. La velocidad de la difusión del agua se denomina velocidad de la osmosis.
Relación entre moles y osmoles
Como la concentración de agua en una solución depende del número de partículas de soluto en la solución, es necesario un término referido a la concentración para describir la composición total de partículas de soluto, sin importar su composición exacta.
El número total de partículas en una solución se mide en osmoles. Un osmol (osm) es igual a 1 mol (mol) (6,02 x 1023) de partículas de soluto. Luego una solución que contenga 1 mol de glucosa en cada litro tiene una concentración de 1 osm/L. Si una molécula se disocia en dos iones (dando dos partículas), como el cloruro de sodio que se ioniza en iones cloro y sodio, entonces una solución que contenga 1 mol/L tendrá una concentración osmolar de 2 osm/L. Además, una solución que contenga 1 mol de una molécula que se disocia en tres iones, como el sulfato de sodio (Na2S04), contendrá 3 osm/L.
Luego el término osmol se refiere al número de partículas con actividad osmótica en una solución en lugar de la concentración molar. En general, el osmol es una unidad demasiado grande para expresar la actividad osmótica de los solutos en los líquidos corporales. En general se usa el término miliosmol (mOsm), que es igual a 1/1.000 osmoles.
Líquidos isotónicos, hipotónicos e hipertónicos
Si una célula se coloca en una solución de solutos no difusibles con una osmolaridad de 282 mOsm/L, las células no se encogerán ni hincharán porque la concentración de agua en los líquidos extracelular e intracelular es igual y los solutos no pueden entrar ni salir de la célula. Se dice que este tipo de solución es isotónica porque ni encoge ni hincha las células. Ejemplos de soluciones isotónicas son la solución de cloruro de sodio al 0,9% o la solución de glucosa al 5%. Estas soluciones son importantes en la medicina clínica porque pueden infundirse en la sangre sin poner en peligro el equilibrio osmótico entre los líquidos intracelular y extracelular.
Si se coloca una célula en una solución hipotónica que tiene una menor concentración de solutos no difusibles (menos de 282mOsm/l), el agua se difundirá al interior de la célula hinchándola; el agua continuará difundiendo al interior de la célula diluyendo el líquido intracelular mientras concentra el líquido extracelular hasta que ambas soluciones tengan la misma osmolaridad.
Las soluciones de cloruro de sodio con una concentración menor de un 0,9% son hipotónicas e hincharán a la célula.
Si se coloca una célula en una solución hipertónica con una solución mayor de solutos no difusibles, el agua saldrá de la célula hacia el líquido extracelular concentrando el líquido intracelular y diluyendo el líquido extracelular. En este caso la célula se contraerá hasta que las dos concentraciones se igualen. Las soluciones de cloruro de sodio mayores del 0,9% son hipertónicas.
Anomlías clínicas de la regulación del volumen de líquido: hiponatremia e hipernatremia
La principal medida de que dispone el clínico para evaluar el estado hídrico de un paciente es la concentración plasmática de sodio. La osmolaridad plasmática no se mide habitualmente, pero como el sodio y sus aniones asociados (sobre todo el cloro) son responsables de más del 90% del soluto en el líquido extracelular, la concentración plasmática de sodio es un indicador razonable de la osmolaridad plasmática en muchas condiciones. Cuando la concentración plasmática de sodio se reduce más de unos pocos miliequivalentes por debajo de la normalidad (unos 142mEq/l), se dice que una persona tiene una hiponatremia. Cuando la concentración plasmática de sodio está elevada por encima de lo normal, se dice que una persona tiene una hipernatremia.
Causas de hiponatremia: exceso de agua o pérdida de sodio
La reducción de la concentración plasmática de sodio puede deberse a una pérdida de cloruro de sodio en el líquido extracelular o a una adición de un exceso de agua al líquido extracelular. Una pérdida primaria de cloruro de sodio suele dar lugar a una hiponatremia-deshidratación y se acompaña de una reducción del volumen de líquido extracelular. Los trastornos que pueden causar una hiponatremia debida a la pérdida de cloruro de sodio son la diarrea y los vómitos. El consumo excesivo de diuréticos que inhiben la capacidad de los riñones de conservar el sodio y ciertos tipos de nefropatías que cursan con pérdida de sodio pueden provocar también grados modestos de hiponatremia.
Finalmente, la enfermedad de Addison, que se debe a una menor secreción de la hormona aldosterona, reduce la capacidad de los riñones de reabsorber el sodio y provoca un grado modesto de hiponatremia. La hiponatremia también puede acompañarse de una retención excesiva de agua, lo que diluye el sodio en el liquido extracelular, un estado que se denomina hiponatremia-sobrehidratación. Por ejemplo, la secreción excesiva de hormona antidiurética, que hace que el túbulo renal reabsorba más agua, puede provocar una hiponatremia y una sobrehidratación.
Consecuencias de hiponatremia: inflamación celular
Los rápidos cambios en el volumen celular como consecuencia de hiponatremia pueden tener efectos profundos en la función de los tejidos y los órganos, especialmente el encéfalo. Por ejemplo, una rápida reducción en la concentración de sodio en plasma puede provocar un edema de las células encefálicas y síntomas neurológicos, como cefalea, náuseas, letargo y desorientación. Si la concentración de sodio en plasma disminuye rápidamente por debajo de 115-120 mmol/l, la inflamación encefálica puede conducir a convulsiones, coma, daño cerebral permanente y muerte. Como el cráneo es rígido, el encéfalo no puede aumentar de volumen más de un 10%, aproximadamente, sin verse forzado a extenderse hacia el cuello (hernia), lo que puede producir una lesión cerebral permanente y la muerte. Cuando la hiponatremia evoluciona más lentamente durante varios días, el encéfalo y otros tejidos responden mediante el transporte de sodio, cloruro, potasio y solutos orgánicos, como glutamato, desde las células al compartimiento extracelular. Así se atenúa el flujo osmótico de agua a las células y la inflamación de los tejidos.No obstante, el transporte de solutos desde las células durante una hiponatremia de desarrollo lento puede hacer que el encéfalo sea vulnerable a lesiones si la hiponatremia se corrige con demasiada rapidez.
Cuando se añaden soluciones hipertónicas demasiado rápido para corregir la hiponatremia, tal vez se supere la capacidad del encéfalo de reabsorber los solutos perdidos de las células, lo cual puede conducir a una lesión osmótica de las neuronas que se asocia con desmielinización, una pérdida de la vaina de mielina de los nervios. Esta desmielinización de neuronas mediada osmóticamente puede evitarse si se limita la corrección de la hiponatremia crónica a menos de 10-12mmol/l en 24h y a menos de 18 mmol/l en 48 h. Esta lenta velocidad de corrección permite que el encéfalo se recupere de la pérdida de osmoles que ha tenido lugar como consecuencia de la adaptación a la hiponatremia crónica.La hiponatremia es el trastorno de electrólitos más común que se encuentra en la práctica clínica y puede producirse en hasta el 15-25% de los pacientes hospitalizados.
Causas de hipernatremia: pérdida de agua o exceso de sodio
El aumento de la concentración plasmática de sodio, que también aumenta la osmolaridad, puede deberse a una pérdida de agua del líquido extracelular, lo que concentra los iones sodio, o a un exceso de sodio en el líquido extracelular.
Cuando hay una pérdida primaria de agua del líquido extracelular, esto da lugar a una hipernatremia-deshidratación. Este trastorno puede deberse a una incapacidad para secretar hormona antidiurética, que es necesaria para que los riñones conserven el agua. Como resultado de la pérdida de hormona antidiurética, los riñones excretan grandes cantidades de orina (una enfermedad denominada diabetes insípida) y dan lugar a una deshidratación y un aumento de la concentración de cloruro de sodio en el líquido extracelular. En ciertos tipos de nefropatías, los riñones no pueden responder a la hormona antidiurética y provocan también un tipo de diabetes insípida nefrógena.
Una causa más común de hipernatremia asociada a una reducción del volumen de líquido extracelular es la deshidratación causada por una ingestión de agua que es inferior a su pérdida, como puede ocurrir en la sudoración durante un ejercicio intenso y prolongado.La hipernatremia también puede deberse a un exceso de cloruro de sodio añadido al líquido extracelular. Esto da lugar a menudo a una hipernatremia-sobrehidratación, porque el exceso de cloruro de sodio extracelular suele asociarse al menos a cierto grado de retención de agua por los riñones.
Por ejemplo, la secreción excesiva de la hormona ahorradora de sodio aldosterona puede causar un grado leve de hipernatremia o sobrehidratación. La razón de que la hipernatremia no sea más intensa es que la mayor secreción de aldosterona hace que los riñones reabsorban mayores cantidades de agua y de sodio.Luego al analizar las anomalías en la concentración plasmática de sodio y decidir el tratamiento adecuado, primero debemos determinar si la anomalía se debe a una pérdida o ganancia primaria de sodio o a una ganancia o pérdida primaria de agua.
Consecuencias de hipernatremia: contracción celular
La hipernatremia es mucho menos común que la hiponatremia y los síntomas graves suelen producirse únicamente con aumentos rápidos e importantes en la concentración de sodio en plasma de más de 158-160 mmol/L.
Un motivo que explica esto es que la hipernatremia promueve una sed intensa que protege contra un aumento importante en el sodio en el plasma y el líquido extracelular.
No obstante, puede producirse una hipernatremia grave en pacientes con lesiones en el hipotálamo que alteren su sensación de sed, en lactantes que puedan no tener un acceso fácil al agua o en ancianos con un estado mental alterado. La corrección de la hipernatremia puede conseguirse mediante la administración de soluciones hipoosmóticas de dextrosa o cloruro de sodio. Sin embargo, es prudente corregir la hipernatremia lentamente en pacientes con enfermedades crónicas en la concentración de sodio en plasma, ya que la hipernatremia activa también los mecanismos de defensa que protegen a la célula de los cambios de volumen. Estos mecanismos de defensa son opuestos a los que se producen en caso de hiponatremia y consisten en mecanismos que aumentan la concentración intracelular de sodio y otros solutos.
Edema: exceso de líquido en los tejidos
El edema se refiere a la presencia de un exceso de líquido en los tejidos corporales. En la mayoría de los casos el edema aparece sobre todo en el compartimiento de líquido extracelular, pero puede afectar también al líquido intracelular.
Edema intracelular
Tres procesos causan especialmente tumefacción o edema intracelular:
- la hiponatremia, según se ha comentado anteriormente,
- la depresión de los sistemas metabólicos de los tejidos y
- la falta de una nutrición celular adecuada. Por ejemplo, cuando se reduce el flujo sanguíneo a un tejido, el reparto de oxígeno y nutrientes se reduce. Si el flujo sanguíneo disminuye mucho como para mantener el metabolismo normal tisular, se deprimen las bombas iónicas de la membrana celular. Cuando esto ocurre, los iones sodio que normalmente se filtran hacia el interior de la célula ya no pueden salir bombeados de las células, y el exceso de sodio intracelular causas por osmosis el paso del agua al interior de las células. A veces esto puede incrementar el volumen intracelular de una zona de tejido (incluso de toda una pierna isquémica, por ejemplo) hasta dos a tres veces el volumen normal. Cuando esto ocurre, suele ser el preludio de la muerte del tejido.
El edema intracelular también puede producirse en los tejidos inflamados. La inflamación suele aumentar la permeabilidad de las membranas celulares, lo que permite aL sodio y a otros iones difundir hacia el interior de la célula, con la posterior entrada del agua por osmosis al interior de las células.
Edema extracelular
El edema extracelular se produce cuando hay un exceso de Acumulación de líquido en los espacios extracelulares. Hay dos causas generales de edema extracelular:
- la fuga anormal de líquido del plasma hacia los espacios intersticiales a través de los capilares y
- la imposibilidad de los linfáticos de devolver el líquido a la sangre desde el intersticio, lo que- menudo se conoce por linfedema. La causa clínica más común de la acumulación intersticial de líquido es la filtración capilar excesiva de líquido.
Resumen de las causas del edema extracelular
Un gran núm ero de trastornos puede causar la acumulación de líquido en los espacios intersticiales por la fuga anormal de líquido de los capilares o porque impidan que los linfáticos devuelvan el líquido desde el intersticio hacia la circulación. La siguiente es una lista parcial de trastornos que pueden provocar un edema extracelular por estos dos tipos de anomalías:
-
Aumento de la presión capilar
A. Retención renal excesiva de sal y agua: Insuficiencia renal aguda o crónica; Exceso de mineralocorticoides
B. Presión venosa alta y constricción venosa: Insuficiencia cardíaca; Obstrucción venosa; Fallo de las bombas venosas (Parálisis de los músculos, Inmovilización de partes del cuerpo, Insuficiencia de las válvulas venosas)
C. Reducción de la resistencia arteriolar: Calor corporal excesiv;. Insuficiencia del sistema nervioso simpático; Fármacos vasodilatadores -
Reducción de las proteínas plasmáticas
A . Pérdida de proteínas en la orina (síndrome nefrótico)
B. Pérdida de proteínas de zonas desprovistas de pie: Quemaduras; Heridas
C. Síntesis insuficiente de proteínas: Hepatopatías (p. ej., cirrosis); Malnutrición proteica o calórica grave -
Aumento de la permeabilidad capilar
A . Reacciones inmunitarias que provocan la liberación de histamina y otros productos inmunitarios
B. Toxinas
C. Infecciones bacterianas
D. Deficiencia de vitaminas, en especial de vitamina C
E. Isquemia prolongada
F. Quemaduras -
Bloqueo del drenaje linfático
A . Cáncer
B. Infecciones (p. ej., nematodos filarías)
C. Cirugía
D. Falta o anomalía congènita de vasos linfáticos
FIN DE LA 1ª PARTE
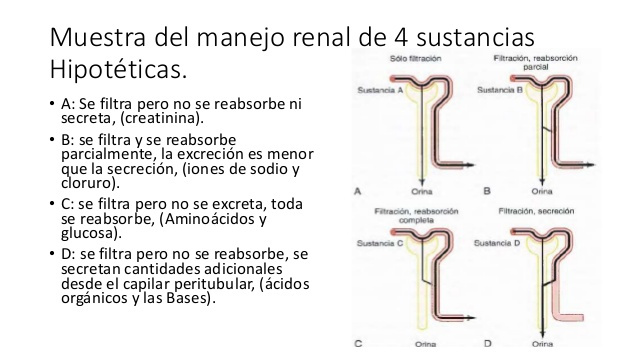
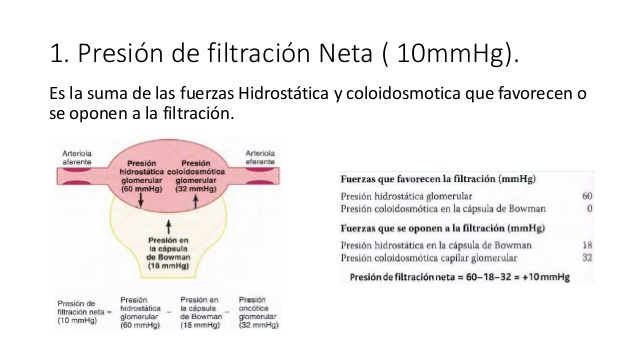
PARTE 2: Formación de la orina por los riñones